年度好文丨马雄教授团队:MDSC参与IgG4相关硬化性胆管炎的发病机制研究-Hepatology
—— 作者: 时间:2019-01-30
阅读数:
568
开年巨献!2019年1月,一场中国高质量临床论文盛宴——“第二届感染病与肝病卓越研究年度论坛(LIFILD)”在上海召开。2018年度在国际顶级期刊上发表重要临床型科学论文的中国团队齐聚于此,共话临床研究成果和研究过程中不为人知的精彩路程。
上海交通大学医学院附属仁济医院马雄教授团队在2018年发现了自身免疫性肝病“新宠”——IgG4相关硬化性胆管炎(IgG4-SC)的发病新机制,他在报告中指出“创新”是这项研究获得认可,成果得以在Hepatology杂志顺利发表的“第一要素”。
连敏 马雄
上海交通大学医学院附属仁济医院消化内科
上海市消化疾病研究所
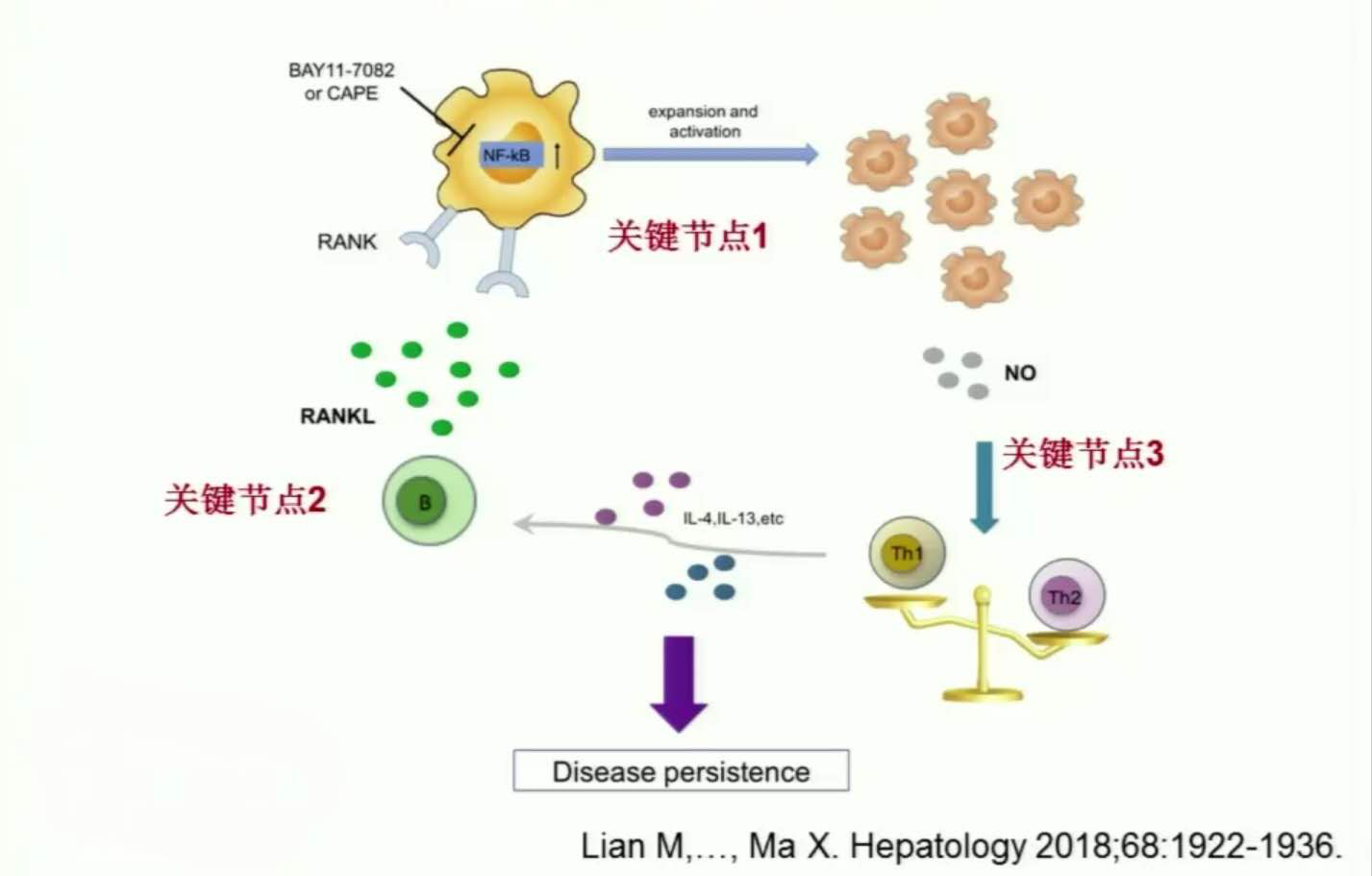
马雄教授团队揭示IgG4-SC发病新机制:浆细胞来源的RANKL可诱导MDSCs的扩增和活化
一、以临床需求为导向
IgG4相关硬化性胆管炎(IgG4-Related Sclerosing Cholangitis,IgG4-SC)是新晋确立统一诊断名称并受到研究关注的一类自身免疫性肝病,作为IgG4相关疾病(IgG4-Related Disease, IgG4-RD)累及肝内外大胆管时的疾病命名,具有IgG4-RD这一大类疾病的共同特点,包括血清IgG4升高(>135 mg/dL),组织学见席纹状纤维化、大量淋巴浆细胞浸润、IgG4阳性浆细胞比例高、闭塞性静脉炎、轻至中度嗜酸性粒细胞浸润。
IgG4-SC患者虽多数对激素治疗应答,但极易复发,一旦病情未经控制,进展至肝硬化、肝衰竭等终末期肝病阶段时,目前的糖皮质激素等传统药物治疗效果较差。因此,阐明IgG4-SC发病机制,并在此基础上寻找敏感性和特异性兼具的早期诊断新标志物和特异性治疗靶点,是我们所面临的刻不容缓的科学问题之一。
二、另辟蹊径,探索IgG4-SC免疫调控机制
目前研究对IgG4-RD的认识有限,在某些抗原刺激下诱发B细胞激活及大量IgG4分泌,以及T淋巴细胞持续激活产生促炎、促纤维化因子,最终导致纤维化进展。有学者提出假说,认为IgG4-SC患者的机体可能存在选择性调节障碍,从而导致免疫应答向Th2方向倾斜。
1、MDSC
髓系源性抑制细胞(Myeloid Derived Suppressor Cells,MDSC)是一群骨髓来源的祖细胞和未成熟细胞的异质性细胞群,具有强大的抑制免疫应答效应,在多种免疫介导的疾病,包括肿瘤、慢性乙型肝炎、自身免疫性疾病等中都发挥了关键作用。在病理情况下,MDSC可接受炎症因子、髓系生长因子等信号信息,从而诱导扩增活化。目前为止,有关IgG4-SC的发病机制研究多数集中于T、B细胞等淋巴细胞领域,而髓系细胞参与的调控鲜有报道,特别是MDSC在IgG4-SC发生过程中的作用及机制尚未阐明。
2、RANKL-RANK信号通路
在研究IgG4-SC的发病过程中,有一种炎症因子引起学者的关注。NF-κB受体激活蛋白配体(Receptor Activator for NF-κB Ligand,RANKL),又名为TNFSF11,属于TNF超家族成员,其受体即NF-κB受体激活蛋白(Receptor Activator for NF-κB,RANK),最早发现RANKL-RANK通路参与破骨细胞分化成熟和淋巴结发育调控,随后研究证实,其对B细胞、髓系细胞的分化发育具有重要作用。目前研究认为,RANKL-RANK通路在自身免疫性关节炎、慢性肝病中可能发挥促炎作用。
三、研究思路与成果
本研究共纳入31例未治疗的活动性IgG4-SC患者,并选取17例原发性硬化性胆管炎(Primary Sclerosing Cholangitis,PSC)患者、30例自身免疫性肝炎(Autoimmune Hepatitis,AIH)患者,以及40名健康志愿者(Healthy Control,HC)作为对照组。
1、MDSC和RNAKL在IgG4-SC高表达
为探究IgG4-SC患者的MDSC表达情况,我们利用流式细胞术来检测MDSC的细胞表型标志物,并以HLA-DR-/loCD33+CD11b+来定义该细胞。我们发现相较于疾病对照组,包括PSC患者和AIH患者,以及健康对照组(HC),IgG4-SC患者外周血MDSC的比例和数量均显著增加,而且以CD14+CD15- 的单核细胞型MDSC升高为主。
为进一步明确RANKL-RANK信号通路在IgG4-SC发病机制中的作用,我们应用酶联免疫吸附实验(ELISA)和免疫组化染色进行检测,结果发现,与其他分组相比,IgG4-SC患者肝内和血清中的RANKL的表达水平大幅增加。
正常肝组织中见不到RANKL阳性细胞,但在IgG4-SC患者肝内,受损的小叶间胆管周围可见RANKL阳性细胞显著聚集。分泌RANKL的细胞与成熟浆细胞的细胞标志物CD19、CD38和CD138,特别是CD38的定位一致。而MDSCs(特别是单核细胞性MDSC)在肝脏内表达RANK。
进一步的,在我们将外周血RANKL水平与IgG4-SC患者临床生化指标作关联分析时,RANKL与IgG、IgG4,尤其是IgG4/IgG呈正相关关系,进一步支持产生免疫球蛋白的成熟浆细胞分泌RANKL在IgG4-SC发病机制中的作用。
2、MDSC为什么升高?——RNAKL诱导MDSC的扩增
在我们将31例IgG4-SC患者外周血RANKL的表达水平、MDSC比例与临床生化指标进一步做相关性分析时,通过spearman相关分析发现,外周血的RANKL水平与患者γ-谷氨酰转移酶(GGT)水平成负相关(R2=0.1633,P=0.0365),但与外周血MDSC的比例成显著正相关(R2=0.4865,P<0.0001)。上述结果提示IgG4-SC患者的MDSC聚集与RANKL高水平表达有关。
为验证RANKL对MDSC的直接诱导扩增作用,我们构建了体外诱导MDSC的培养体系,并对RANKL诱导的最佳培养时间和剂量进行摸索。结果显示,当RANKL的浓度为25 ng/mL,诱导培养5天时,可观察到显著的MDSC扩增,且扩增效果不劣于阳性对照组。
进行PAN T细胞增殖功能抑制实验证实,RANKL诱导扩增的MDSC(无论联合或不联合GM-CSF),都能显著抑制PAN T细胞的增殖,且当MDSC:PAN T细胞的细胞比例为1:4时,其免疫抑制效应最佳,通过流式细胞术检测一氧化氮(NO)的代谢产物DAF-FM-DA发现,RANKL诱导扩增的MDSC表达更高水平的NO。上述实验证实,RANKL诱导扩增的MDSC具有其特异性的免疫抑制功能。
此外,我们发现RANKL可通过促使MDSC表面的趋化受体CCR5、CXCR3以及CX3CR1表达丰度升高,诱导MDSC向肝脏募集。由于RANKL与其受体RANK结合后可激活NF-κB信号通路,我们利用NF-κB的通路抑制剂BAY 11-7082和CAPE,阻断细胞内NF-kB信号通路的激活,可以发现,在加入抑制剂后,MDSC的扩增效应不再。
3、MDSC升高后效应?——MDSC调控CD4+T细胞的分化
在明确RANKL诱导扩增有免疫抑制效应的MDSC的机制之后,我们专注于MDSC的抑制功能对IgG4-SC疾病发生发展的影响。我们利用健康志愿者的外周血单个核细胞(PBMC),建立体外诱导Th1和Th2型细胞分化的培养体系。
有趣的是,在诱导Th2型分化的培养体系中,加入GM-CSF联合IL-6诱导的MDSC仍抑制T细胞的分化,而加入RANKL诱导的MDSC后T细胞向Th2分化程度更高,在RANKL诱导的MDSC与Th2型细胞分化共培养体系中,加入iNOS抑制剂1400W,则能显著抑制RANKL诱导扩增的MDSC发挥促Th2型分化作用。
因此,我们推测IgG4-SC患者体内升高的MDSC可能通过分泌NO,促进T细胞向Th2型分化,从而加重疾病进展。
四、小结与展望:
总结上述工作,我们创新性地发现,IgG4-SC患者体内浆细胞来源的RANKL能诱导MDSCs的扩增和活化,后者可调控CD4+ T细胞的分化方向,揭示导致IgG4-SC慢性化和纤维化发生的疾病新机制。
MDSCs作为骨髓来源的免疫调节细胞,积极参与IgG4-SC免疫微环境中的“肝-骨对话”,RANKL诱导的MDSC信号途径可能作为未来治疗IgG4-SC的免疫治疗靶点。
点击“阅读原文”,可下载论文PDF
标签:
研究
自身免疫性肝病
发表评论
全部评论
