当前位置:AASLD-美国肝病研究学会年会 » 正文
AASLD热评︱丁惠国教授:CCL2介导的血管分泌信号通路可缓解肝纤维化及门脉高压的新机制
—— 作者: 时间:2019-11-13 04:48:27 阅读数:
287

编者按:慢性肝病中血管分泌信号(Angiocrine signaling)分子的变化可导致巨噬细胞募集及肝星状细胞(Hepatic stellate cell, HSC)活化,参与肝纤维化和门脉高压的发生、发展。P300作为共转录因子,在HSC参与肝纤维化信号通路中具有作用。然而,肝窦内皮细胞(Liver sinusoidal endothelial cell, LSEC)特异性p300基因在调节血管分泌信号和门脉高压发生中的作用尚不清楚。2019年AASLD年会,在门脉高压症实验与临床转化医学专栏中,来自罗切斯特梅奥临床医学中心(Mayo Clinic,Rochester)胃肠肝病科高金航博士报道:肝窦内皮细胞P300基因缺失降低门脉高压及缓解肝纤维化的机制是,通过抑制CCL2(又称单核细胞趋化因子-1,MCP-1)介导的血管分泌信号通路。本刊特邀首都医科大学附属附属北京佑安医院肝病消化中心丁惠国教授对该项研究进行点评。
研究者将Cdh5CreERT2?小鼠与p300fl/fl小鼠杂交得到具有LSEC特异性p300基因缺失的小鼠以获得p300ΔLSEC,分别采用部分下腔静脉结扎(pIVCL)诱导小鼠非肝硬化门脉高压和注射四氯化碳(CCl4)诱导小鼠肝硬化门脉高压2类门脉高压症动物模型。p300抑制剂CBP30预处理原代人LSEC后,采用transwell方法与人HSC共培养。
结果发现,在pIVCL诱导非肝硬化门脉高压小鼠模型中,门脉压力增加及HSC活化增强。与p300fl/fl对照组相比,p300ΔLSEC组门静脉压力降低和HSC活化被抑制(n = 6,P <0.05)。在CCl4小鼠模型中,与p300fl/fl对照组相比,p300ΔLSEC组门静脉压力降低和肝纤维化缓解(n = 6,P <0.05)。并且,与p300fl/fl对照组相比,在CCl4小鼠模型中,p300ΔLSEC组HSC活化标志物(aSMA),总巨噬细胞标志物(CD68,F4 / 80和Mac2)和浸润巨噬细胞标志物(CCR2,Ly6c和S100A9)表达减少(n = 6,P <0.05)。
针对25种炎症、纤维化基因转录的PCR分析显示,CCL2mRNA水平在CCl4诱导的肝硬化门脉高压症模型中分离的LSEC显着增加,并且在p300ΔLSEC组中CCL2mRNA水平减少(n = 6,P <0.05)。在各种原代肝脏细胞中,LSEC的CCL2表达水平最高(n = 3,P <0.05)。在原代小鼠LSEC中,敲除p300基因导致CCL2表达量下降5倍(n = 3,P <0.05)。在原代人LSEC中,CBP30通过抑制p300表达,降低CCL2表达,并在LSEC-HSC共培养中减弱HSC活化(n = 3,P <0.05)。
专家点评
丁惠国教授:该项研究揭示,LSEC p300基因缺失通过抑制CCL2依赖的血管分泌信号通路,抑制HSC活化、巨噬细胞浸润,从而缓解肝纤维化和门脉高压。本研究从炎症因子的角度,阐述了LSEC、HSC与巨噬细胞之间可能的“交叉对话”(Cross talk)关系。
既往研究表明,肝细胞、LSEC、HSC、胆管上皮细胞及kuffer细胞(巨噬细胞)之间“交叉对话”在肝纤维化、肝硬化门脉高压症的发生机制中具有重要作用(图1),但其详细机制仍不清楚,特别是在非肝硬化门脉高压症中的作用尚无研究。LSEC一氧化氮合酶、赖氨酸氧化酶-2表达减少、肝脏新生血管形成及病理性肝窦重建是肝硬化门脉高压的病理生理新机制,通过改善肝窦内皮细胞功能障碍及抑制新生血管形成,可能是延缓、逆转肝硬化门脉高压的新靶点。高博士等报道了LSEC在肝硬化及非肝硬化门脉高压症(Non-cirrhotic portal hypertension,NCPH)中的作用,HSC活化在NCPH进展中可能仍有重要作用。
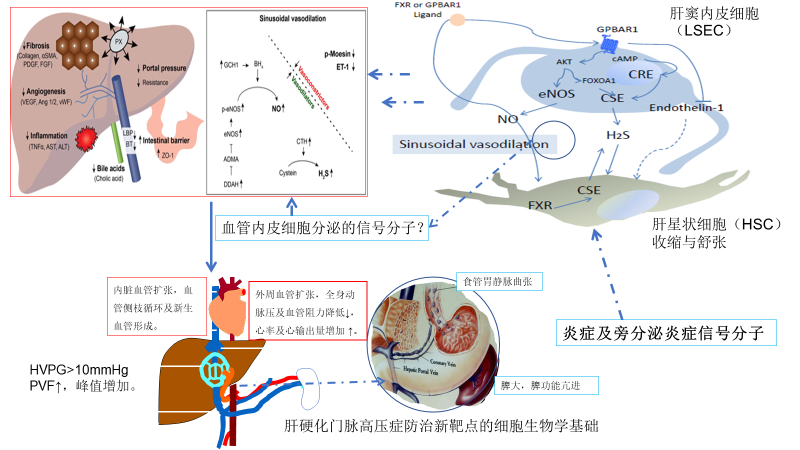
图1.肝细胞、LSEC、HSC、胆管上皮细胞及kuffer细胞(巨噬细胞)之间“交叉对话”
在肝窦周细胞的“交叉对话”中,kuffer或巨噬细胞分泌炎症因子,如CCl2可能影响LSEC功能及HSC活化。另一方面,CCl2可以直接特异性地使炎症细胞向肝细胞炎症坏死、感染、毒素暴露和缺血部位聚集,识别多个趋化因子受体,从而促进肝脏炎症、肝细胞坏死、纤维化及门脉高压的发生与发展。因此,炎症因子或血管分泌信号分子,可能是肝细胞、LSEC、HSC、胆管上皮细胞及kuffer细胞之间“交叉对话”的重要“桥梁”。
原文链接:Jinhang Gao, Enis Kostallari, Mengfei Liu, et al. P300 Deletion in Liver Endothelial Cell Attenuates Portal Hypertension Via Inhibition of CCL2-Mediated Angiocrine Signaling. AASLD 2019 Abstract:0242
标签:
述评/点评
热点聚焦
肝纤维化
发表评论
全部评论