当前位置:AASLD-美国肝病研究学会年会 » 正文
AASLD热评丨陈煜教授:他汀类药物对慢加急性肝衰竭的预防作用,获益还是偏倚?
—— 作者: 时间:2021-12-06 10:24:23 阅读数:
79

高原,陈煜
首都医科大学附属北京佑安医院 肝病中心四科(疑难肝病及人工肝中心)
慢加急性肝功能衰竭(ACLF)是在慢性肝病基础上短期内快速进展并有高死亡率的一种综合征[1]。鉴于其致命风险,临床医生也希望通过一些干预以避免那些肝硬化患者出现急性肝功能失代偿。
今年的美国肝病研究学会年会(AASLD2021)上,Nadim Mahmud等人在线报告了一项题为“STATINS ARE ASSOCIATED WITH REDUCED DEVELOPMENT OF ACUTE ON CHRONIC LIVER FAILURE IN A LARGE NATIONAL COHORT OF PATIENTS WITH CIRRHOSIS”的研究[2]。本期《国际肝病》特邀首都医科大学附属北京佑安医院 肝病中心四科(疑难肝病及人工肝中心)陈煜教授团队对该研究进行详细点评。
研究简介
研究者通过美国退伍军人结局和成本(VOCAL)数据库建立了回顾性队列研究,通过对超过12万人的数据进行倾向性匹配比较,逆概率加权回归模型分析发现,他汀类药物的使用和2级~3级ACLF住院率降低密切相关,而且这种相关性和他汀类药物的剂量密切相关,他汀类药物用量越高,因肝衰竭住院相关风险越低。
点评
通常认为,晚期慢性肝病是他汀类药物的相对禁忌证。但既往研究表明,患者因服用他汀类药物而导致严重药物性肝损伤风险并不常见,且仅见于高剂量他汀类药物[3,4];还有临床研究提示阿托伐他汀(中位剂量24mg Qd)用于存在心血管风险的脂肪肝患者,长期使用不仅不会增加肝酶异常的发生,反而有助于肝酶复常[5]。近年来,越来越多的研究证实,他汀类药物对于慢性肝病患者存在多重益处,包括降低门静脉压力、改善肝窦内皮和肝微血管功能障碍、减轻纤维化等[6,7]。
ACLF经常与促炎性诱发事件(例如,感染或酒精性肝炎)密切相关。他汀类药物在动物实验中展现出对肝内炎症的抑制,抑制肝脏星状细胞活化,且具有使肝细胞凋亡减低的效能[8-10],不仅有助于控制肝纤维的进展,也有潜力用于降低促炎性事件导致的肝脏不良预后。
Nadim Mahmud等报道的研究似乎提示了他汀类药物用于阻止ACLF发生的潜力。表1为本项研究基线随访开始时使用他汀类药物或随访开始后使用他汀类药物的人群,其肝硬化病因中非酒精性脂肪性肝病(NAFLD)比例显著高于非他汀类药物人群,此外使用他汀类药物人群的2型糖尿病、冠心病、心衰比例也显著高于非他汀类药物人群。这里提示三点:
NAFLD所致肝纤维化/肝硬化的进展速度通常慢于酒精肝或病毒性肝炎导致的肝纤维化/肝硬化进展速度,因此病因学不同可能导致出现ACLF结局的组间差异;此外,他汀类药物使用人群存在更高的心血管事件风险,而心血管事件导致死亡会在研究中成为ACLF这一观察终点事件的竞争风险[11];胆固醇主要通过肝脏合成,胆固醇水平反映肝脏储备情况。他汀类药物以总胆固醇/低密度脂蛋白胆固醇为治疗靶点。因此,在基线胆固醇水平相近的情况下,接受他汀类药物治疗患者的自然胆固醇水平应更高,对应更好的肝脏合成储备能力,这可能造成选择偏倚。
表1.基线随访开始时使用他汀类药物或随访开始后使用他汀类药物的人群特征
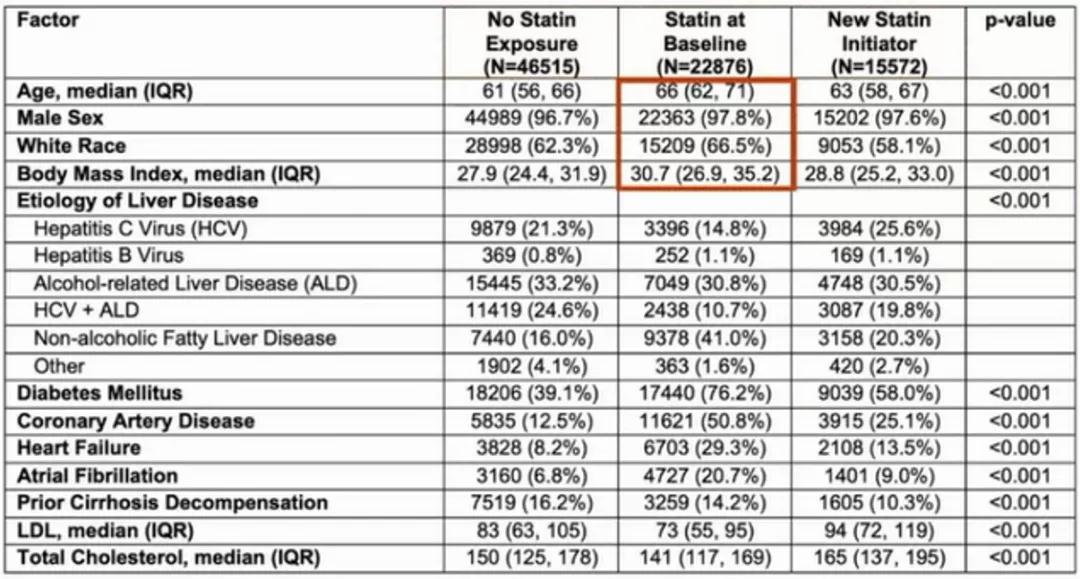
(引自AASLD2021会议摘要)
需要注意的一点是,部分人群暴露于他汀类药物是在开始观察后的,这不可避免地会造成恒定时间偏倚[12],在既往大型数据库的真实世界研究中,恒定时间偏倚会造成结局显著倾向有利于干预措施的结论[13],在缺乏全文数据情况下尚不清楚作者是否对此进行校正。如果研究确实需要校正倾向匹配分数,则可以使用具有时间条件的倾向分数的流行病学设计来避免这种偏差[14],也可以通过他汀类药物暴露的不同时间截点进行敏感性分析以明确是否存在恒定时间偏倚的干扰[15]。
真实世界证据和随机对照研究互为补充,均成为临床参考的循证证据的重要来源。然而,质量和来源不确定的大型数据集、非专家可以使用的便捷分析工具,当和缺乏精通方法论或缺乏疾病机制理解的研究人员相结合时,可能导致构思不合理的研究或分析设计,从而产生不正确或不可靠的结论[16]。对真实世界数据的正确利用不仅不是一种简化版研究,反而是对医学研究者提出了更高的要求。未来研究他汀类药物能否在肝脏疾病领域展现出独立于调脂功能外的再利用潜力,可考虑先对其干预机制进行充分研究,再过渡到严格控制条件、使用测量数据作为替代终点的临床对照研究。
参考文献:
1.Arroyo V, Moreau R, Jalan R. Acute-on-Chronic Liver Failure. N Engl J Med, 2020, 382: 2137-2145.
2.Nadim Mahmud, David S Goldberg, K Rajender Reddy, et al. STATINS ARE ASSOCIATED WITH REDUCED DEVELOPMENT OF ACUTE ON CHRONIC LIVER FAILURE IN A LARGE NATIONAL COHORT OF PATIENTS WITH CIRRHOSIS. AASLD2021, oral-205.
3.Dale KM, White CM, Henyan NN, et al. Impact of statin dosing intensity on transaminase and creatine kinase. Am J Med, 2007, 120: 706-712.
4.Chang CH, Chang YC, Lee YC, et al. Severe hepatic injury associated with different statins in patients with chronic liver disease: a nationwide population-based cohort study. J Gastroenterol Hepatol, 2015, 30: 155-162.
5.Athyros VG, Tziomalos K, Gossios TD, et al. Safety and efficacy of long-term statin treatment for cardiovascular events in patients with coronary heart disease and abnormal liver tests in the Greek Atorvastatin and Coronary Heart Disease Evaluation (GREACE) Study: a post-hoc analysis. Lancet, 2010, 376: 1916-1922.
6.Pose E, Trebicka J, Mookerjee RP, et al. Statins: Old drugs as new therapy for liver diseases? J Hepatol, 2019, 70: 194-202.
7.Bosch J, Gracia-Sancho J, Abraldes JG. Cirrhosis as new indication for statins. Gut, 2020, 69: 953-962.
8.Jain MK, Ridker PM. Anti-inflammatory effects of statins: clinical evidence and basic mechanisms. Nat Rev Drug Discov, 2005, 4: 977-987.
9.La Mura V, Pasarín M, Meireles CZ, et al. Effects of simvastatin administration on rodents with lipopolysaccharide-induced liver microvascular dysfunction. Hepatology, 2013, 57: 1172-1181.
10.Meireles CZ, Pasarin M, Lozano JJ, et al. Simvastatin Attenuates Liver Injury in Rodents with Biliary Cirrhosis Submitted to Hemorrhage/Resuscitation. Shock, 2017, 47: 370-377.
11.Wu L, Ge C, Zheng H, et al. Establishing a Competing Risk Regression Nomogram Model for Survival Data. J Vis Exp, 2020.
12.Suissa S. Lower Risk of Death With SGLT2 Inhibitors in Observational Studies: Real or Bias? Diabetes Care, 2018, 41: 6-10.
13.Kosiborod M, Cavender MA, Fu AZ, et al. Lower Risk of Heart Failure and Death in Patients Initiated on Sodium-Glucose Cotransporter-2 Inhibitors Versus Other Glucose-Lowering Drugs: The CVD-REAL Study (Comparative Effectiveness of Cardiovascular Outcomes in New Users of Sodium-Glucose Cotransporter-2 Inhibitors). Circulation, 2017, 136: 249-259.
14.Suissa S, Moodie EE, Dell'Aniello S. Prevalent new-user cohort designs for comparative drug effect studies by time-conditional propensity scores. Pharmacoepidemiol Drug Saf, 2017, 26: 459-468.
15.Geleris J, Sun Y, Platt J, et al. Observational Study of Hydroxychloroquine in Hospitalized Patients with Covid-19. N Engl J Med, 2020, 382: 2411-2418.
16.Sherman RE, Anderson SA, Dal Pan GJ, et al. Real-World Evidence - What Is It and What Can It Tell Us? N Engl J Med, 2016, 375: 2293-2297.

专家简介
陈煜
主任医师,教授,博士生导师,首都医科大学附属北京佑安医院肝病中心四科主任(疑难肝病与人工肝中心主任),中华医学会肝病学分会副秘书长、委员、终末期肝病学组副组长,北京医学会肝病学分会常委、肝衰竭及人工肝学组副组长,全国重型肝病及人工肝血液净化攻关协作组副组长,佑安肝病感染病专科医疗联盟肝衰竭及人工肝专委会主任委员,中国研究型医院学会肝病专业委员会重症肝病学组副组长,中国重症血液净化协作组副主任委员、人工肝学组组长,中国医药教育协会肝病专业委员会常委,中国医师协会急救复苏专业委员会委员,北京医院协会医疗管理科学专业委员会委员,北京市科技新星,北京市卫生局“十百千”卫生百名人才,北京市卫生系统高层次卫生技术人才,北京市优秀人才。
《中华肝脏病杂志》、《临床肝胆病杂志》、《实用肝脏病杂志》、《胃肠病与肝病杂志》审稿专家,曾在中国香港大学医学院、英国伦敦大学医学院做访问学者。长期从事重型肝病肝衰竭及人工肝的应用基础及临床研究。参与举办第一届至第十届全国重型肝病及人工肝血液净化学术年会,参与《人工肝脏治疗学》、《实用人工肝治疗操作手册》、《突发传染病防治教程》、《疑难重症肝病100例》、《全国肝病科普咨询专家规范化培训试题》、《传染病学》及英文版等多部著作的编写。承担国家自然科学基金、“十一五”、“十二五”、“十三五”肝炎重大专项等科研任务,参与科技部科技攻关引导项目、北京市科委科技重大项目等多项重大科研工作。发表论文300余篇,累计发表SCI论文120余篇,累积影响因子近500分。出版专著20余部,获得科研奖项10余项,获得发明专利7项。

作者简介
高原
首都医科大学硕士,博士在读
首都医科大学附属北京佑安医院肝病中心四科(疑难肝病及人工肝中心)副主任医师
肝病专科工作十余年,擅长对危重症肝脏疾病诊治,有多篇文章发表,包括曾在JAMA,NEJM等顶级期刊发表学术评论。对遗传和代谢性肝病有较强理解和前沿进展追踪能力。
标签:
研究
热点聚焦
其他肝病
发表评论
全部评论