JOH丨涨知识!甲型肝炎最新研究进展
—— 作者: 时间:2022-05-19
阅读数:
146
编者按
甲型病毒性肝炎,简称甲型肝炎,是由甲型肝炎病毒(HAV)引起的,以肝脏炎症病变为主的传染病,自8000-10,000年前人类从狩猎-采集状态过渡到群居社会以来,甲型肝炎可能一直困扰着人类。近日,美国北卡罗来纳大学医学院Stanley M. Lemon教授在JOH杂志发表文章,针对这一古老的传染病近十年来通过深入研究取得的突破性进展进行了综述。
众所周知,甲型肝炎主要通过粪-口途径传播,临床上以疲乏、食欲减退、肝肿大、肝功能异常为主要表现,部分病例出现黄疸,主要表现为急性肝炎,无症状感染者常见。任何年龄均可患本病,但主要为儿童和青少年。成人甲型肝炎的临床症状一般较儿童为重。冬春季节常是甲型肝炎发病的高峰期。本病病程呈自限性,无慢性化,引起急性重型肝炎者极为少见。
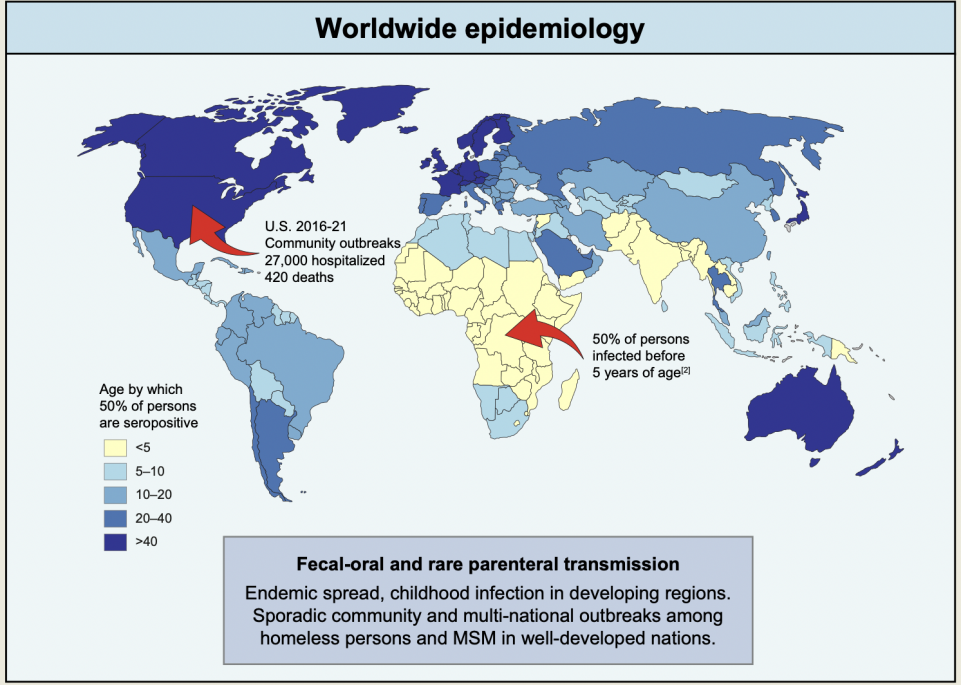
图1. 甲型肝炎的全球流行病学
随着灭活疫苗在全世界的使用,甲型肝炎的流行已得到有效的控制。然而在欠发达地区,尤其是撒哈拉以南非洲,50%的儿童在5.2岁之前感染甲型肝炎。近年来,甲型肝炎再次成为一种公共健康威胁,在美国无家可归者和欧洲男男性行为者中广泛流行(图1)。据统计,美国2016-2021年共计有27,000例甲型肝炎住院病例,其中死亡420例。
HAV为嗜肝RNA病毒属,是小核糖核酸病毒科的一员。HAV经口进入体内后,经肠道进入血流,引起病毒血症,约一周后到达肝脏,随后通过胆汁排入肠道并出现粪便中。粪便排毒能维持1-2周。病毒侵犯的主要器官是肝脏,咽部和扁桃体可能是HAV肝外繁殖的部位。HAV引起肝细胞损伤的机制尚未明确,一般认为HAV不直接引起肝细胞病变,肝脏损害是HAV感染肝细胞的免疫病理反应所引起。
自20世纪90年代甲型肝炎疫苗研发成功后,针对HAV的研究进入了相对休眠期。而在过去十年中,人们又重新燃起了对HAV的研究兴趣,越来越多的研究表明,HAV在系统发育、结构和复制策略方面是非常独特的。
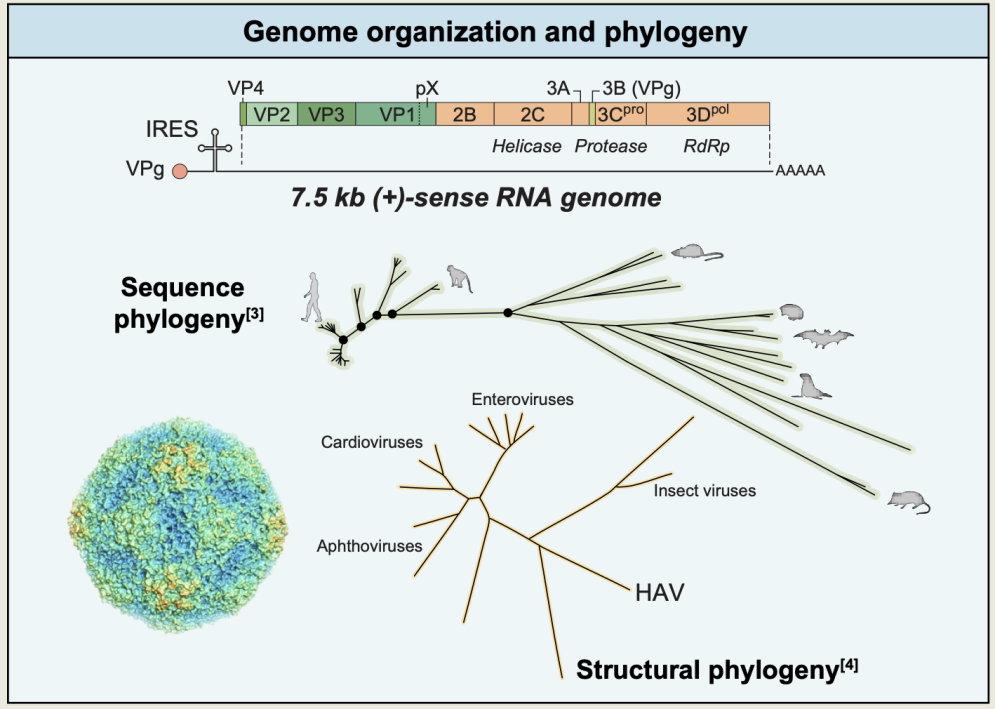
图2. HAV的基因组学和系统发育学
目前,已发现9种与HAV密切相关且截然不同的嗜肝病毒(hepatovirus,图2),而其中只有HAV感染人类。在多种哺乳动物(海豹、蝙蝠、负鼠等)中发现了其他嗜肝病毒。有趣的是,蝙蝠嗜肝病毒在抗原上与人类甲型肝炎相关。HAV的结构不同于脊髓灰质炎病毒以及其他的人类小RNA病毒,具有昆虫类小角RNA病毒的特征。
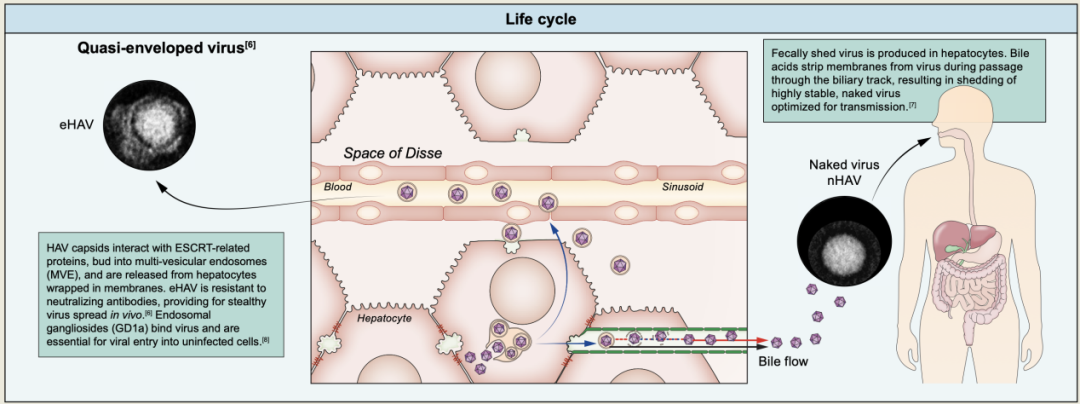
图3. HAV感染的生命周期
HAV具有高度的嗜肝性,并通过隐秘的方式感染肝脏(图3)。内体神经节苷脂(GD1a)与病毒结合,为病毒进入未感染肝细胞所必需。HAV衣壳与ESCRT相关蛋白相互作用,形成多囊泡内质体(MVE),并以表面不携带任何病毒编码蛋白的小泡的形式,从感染的肝细胞释放出来。这些准包膜病毒粒子(eHAV)类似于外质体,具有传染性,并且是迄今在甲型肝炎患者血液中发现病毒的唯一形式。甲型肝炎病毒细胞受体1(TIM1,又称HAVCR1)和其他磷脂酰丝氨酸受体有助于eHAV最初附着于未感染的肝细胞,且eHAV对中和抗体有抵抗力,这为HAV在体内的隐性传播提供了条件。
另一方面,胆道中的胆盐可将eHAV的包膜剥离,形成无包膜病毒(nHAV)。相比之下,粪便中脱落的裸病毒非常稳定,更适合环境传播。

图4. HAV感染小鼠模型
甲型肝炎的肝损伤通常是急性的,在大多数成年人中伴随感染,持续时间大多不超过6个月;主要特征包括肝细胞凋亡、肝内多细胞炎症浸润和血清丙氨酸转氨酶水平升高。甲型肝炎的发病机制可能涉及多种途径。研究表明,在缺乏I型干扰素受体的Ifnar1-/-小鼠中,可感染HAV并能准确模拟人类甲型肝炎(图4)。分析显示,在该小鼠模型中,肝损伤是由干扰素调节因子3(IRF3)介导的转录反应引起。
病毒特异性CD8+T细胞应答对与黑猩猩HAV感染相关的肝损伤贡献甚微,与此相反,它对小鼠的肝损伤具有保护作用。其他机制方面,尤其是非特异性CD8+旁观T细胞的活化可能是住院患者发生重型肝炎的主要原因。
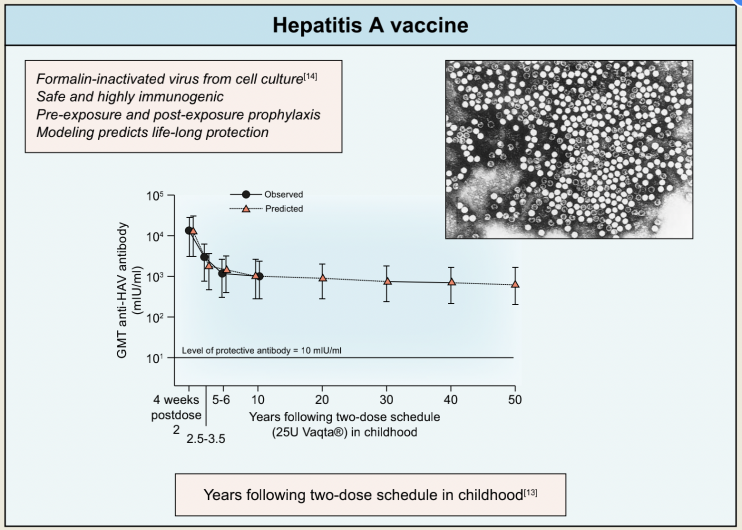
图5. 儿童接种甲型肝炎疫苗后产生的保护性抗体反应
目前尚无治疗甲型肝炎的特异性疗法。灭活甲型肝炎疫苗在灭活,无论既往是否存在HAV暴露,疫苗均有保护性效力。研究表明,儿童接种免疫后产生的保护性抗体反应可持续25~50年(图5)。
参考文献:
[1] Lemon SM, Ott JJ, Van Damme P, Shouval D. Type A viral hepatitis: a summary and update on the molecular virology, epidemiology, pathogenesis and prevention. J Hepatol 2018;68:167–184.
[2] Jacobsen KH. Globalization and the changing epidemiology of hepatitis A virus. Cold Spring Harb Perspect Med 2018;8:a031716.
[3] Sander AL, Corman VM, Lukashev AN, Drexler JF. Evolutionary origins of enteric hepatitis viruses. Cold Spring Harb Perspect Med 2018;8:a031690.
[4] Wang X, Ren J, Gao Q, Hu Z, Sun Y, Li X, et al. Hepatitis A virus and the
origins of picornaviruses. Nature 2015;517:85–88.
[5] Lanford RE, Feng Z, Chavez D, Guerra B, Brasky KM, Zhou Y, et al. Acute hepatitis A virus infection is associated with a limited type I interferon response and persistence of intrahepatic viral RNA. Proc Nat’l Acad Sci USA 2011;108:11223–11228.
[6] Feng Z, Hensley L, McKnight KL, Hu F, Madden V, Ping L, et al. A pathogenic picornavirus acquires an envelope by hijacking cellular membranes. Nature 2013;496:367–371.
[7] Hirai-Yuki A, Hensley L, Whitmire JK, Lemon SM. Biliary secretion of quasi-enveloped human hepatitis A virus. MBio 2016;7. e01998-01916.
[8] Das A, Barrientos RC, Shiota T, Madigan V, Misumi I, McKnight KL, et al. Gangliosides are essential endosomal receptors for quasi-enveloped and naked hepatitis A virus. Nat Microbiol 2020;5:1069–1078.
[9] Hirai-Yuki A, Hensley L, McGivern DR, Gonzalez-Lopez O, Das A, Feng H, et al. MAVS-dependent host species range and pathogenicity of human hepatitis A virus. Science 2016;353:1541–1545.
[10] Zhou Y, Callendret B, Xu D, Brasky KM, Feng Z, Hensley LL, et al. Dominance of the CD4+ T helper cell response during acute resolving hepatitis A virus infection. J Exp Med 2012;209:1481–1492.
[11] Misumi I, Mitchell JE, Lund MM, Cullen J, Lemon SM, Whitmire JK. T cells protect against hepatitis A virus infection and limit infection-induced liver injury. J Hepatol 2021. In press.
[12] Kim J, Chang DY, Lee HW, Lee H, Kim JH, Sung PS, et al. Innate-like cytotoxic function of bystander-activated CD8(+) T Cells is associated with liver injury in acute hepatitis A. Immunity 2018;48:161–173.e165.
[13] Martin JC, Petrecz ML, Stek JE, Simon JK, Goveia MG, Klopfer SO. Using the power law model to predict the long-term persistence and duration of detectable hepatitis A antibody after receipt of hepatitis A vaccine (VAQTATM). Vaccine 2021;39:2764–2771.
[14] Volkin DB, Burke CJ, Marfifia KE, Oswald CB, Wolanski B, Middaugh CR. Size and conformational stability of the hepatitis A virus used to prepare VAQTA, a highly purifified inactivated vaccine. J Pharmaceut Sci 1997;86:666–673.
往期推荐

标签:
循证视点
热点聚焦
甲肝
发表评论
全部评论
