孙剑教授:血清HBV RNA临床应用前景的思考
—— 作者: 时间:2022-07-22
阅读数:
47
编者按:血清HBV RNA是来自肝细胞内cccDNA的直接转录体,主要是未经或部分逆转录的前基因组RNA及其剪切变异体。近年来,研究发现HBV RNA可能是一种具有潜在临床应用价值的新指标。在刚结束不久的第十五届全国肝脏疾病临床学术大会暨第五届华夏肝脏病学联盟年会上,南方医科大学南方医院孙剑教授做了关于血清HBV RNA临床应用的精彩报告,分享了近年来关于血清HBV RNA在临床诊断、抗病毒治疗相关预测以及肝癌相关风险预测等方面的最新研究进展,并就其未来临床应用价值做了深入探讨。本刊特整理报道如下,以飨读者。
血清HBV RNA监测乙肝自然史和疾病进展
慢性HBV感染的自然病程一般可划分为免疫耐受期(IT)、免疫清除期(HBeAg+IA)、免疫控制期(IC)和再活动期(HBeAg-IA)四个分期[1]。临床上慢性HBV感染的不同自然分期的判定对于患者是否启动抗病毒治疗,从而避免错过抗病毒时机而进展为肝硬化至关重要。目前,明确慢性HBV感染自然病程的分期主要依据血清HBV DNA、HBeAg、ALT以及肝脏病理学结果等。然而,由于肝脏病理学证据在临床上常常缺乏,因此仍需探索有效的无创性指标,以帮助我们对慢性HBV感染自然病程进行更好的界定。
表1. 慢性HBV感染自然病程分期

近年来,越来越多的研究表明,HBV RNA在疾病进展中具有监测作用及应用前景。一项小样本量(n=102)的临床研究[2]结果发现,慢性HBV感染者的血清HBV RNA水平与血清HBV DNA、肝内HBV RNA呈高度相关;与肝内HBV DNA和cccDNA呈中等相关;而与ALT、肝活检Metavir评分(n=66)均无显著相关性;并且在不同的慢性HBV感染自然病程分期中,具有以下分布特点:IT>HBeAg+IA>HBeAg-IA>IC。
另一项大样本横断面研究[3]共纳入1409例慢性HBV感染患者,其结果表明,患者血清HBV RNA与血清HBV DNA高度相关,进一步的分层分析表明,在HBeAg阴性患者中,血清HBV RNA与ALT、APRI评分和FIB-4指标呈正相关;而在HBeAg阳性患者中,血清HBV RNA与ALT、APRI评分和FIB-4指标无显著相关性(图1)。
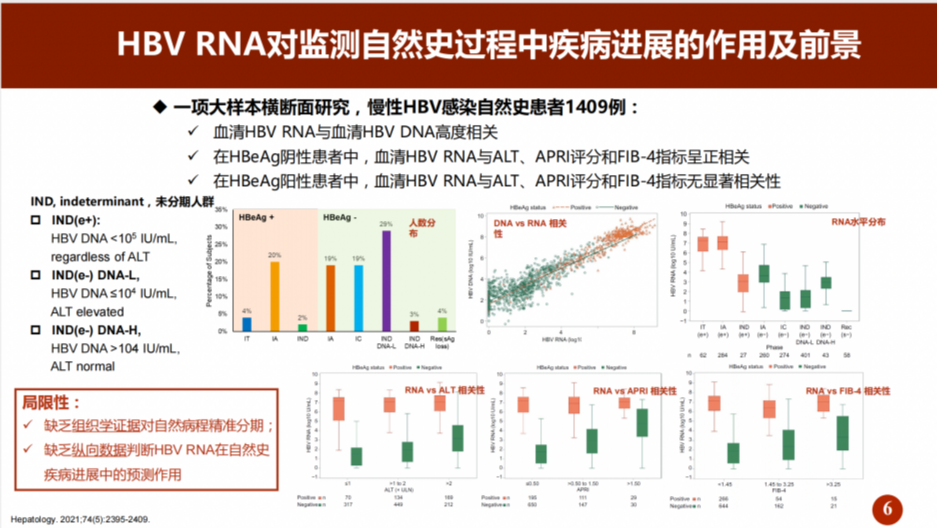
图1. 血清HBV RNA与常规HBV检测指标的相关性
(引自报告幻灯)
虽然以上两项研究由于缺乏组织学证据未对自然病程精准分期,也未针对HBV RNA在疾病进展中的预测作用进行纵向数据分析,但总体而言,它们提示了血清HBV RNA在慢性HBV感染自然史过程中与疾病进展的高度相关性。目前的证据还不足以支持将血清HBV RNA用于区分慢性HBV感染自然病程分期,以及预测肝脏疾病进展,未来仍需大样本、精准分期(含组织学证据)、包含疾病进展信息的队列研究,以进一步明确血清HBV RNA在监测慢性HBV感染自然进程中的作用。
血清HBV RNA预测NA治疗后的HBeAg血清学转换
血清HBV RNA的另一个重要的临床应用方向是用于预测核苷(酸)类似物(NA)在慢性乙型肝炎(CHB)患者抗病毒治疗中的应答,尤其是在预测HBeAg血清学转换方面的作用。
早在2015年,Hepatology杂志发表了一项临床研究[4],共纳入50例接受拉米夫定(LAM)或替诺福韦酯(TDF)治疗的CHB患者,平均治疗30个月,有15例发生HBeAg血清学转换,35例未发生HBeAg血清学转换。分析显示,患者治疗12周或24周时的血清HBV RNA水平可以有效预测NA治疗后的HBeAg血清学转换,并且其预测效能显著优于HBV DNA 和HBsAg等标志物(图2)。该项研究引起了学界的广泛关注,也开启了更多关于血清HBV RNA临床应用的探索。

图2. 血清HBV RNA与其他指标在预测NA治疗后的HBeAg血清学转换中的效能比较
2020年发表的一篇文章[5]同样证实血清HBV RNA在预测NA治疗后的HBeAg血清学转换中的价值。研究共纳入111例HBeAg阳性CHB患者,接受恩替卡韦(ETV)治疗144周,有37例发生了HBeAg血清学转换,74例未发生HBeAg血清学转换。结果发现,治疗12周HBV标志物预测效能:HBV DNA>RNA + HBeAg>HBeAg>RNA>HBsAg;治疗24周HBV标志物预测效能:HBV RNA + HBeAg>HBeAg>RNA>DNA>HBsAg(图3)。总体上,血清HBV RNA可以预测NA治疗后的HBeAg血清学转换,但是其预测效能并不十分理想。
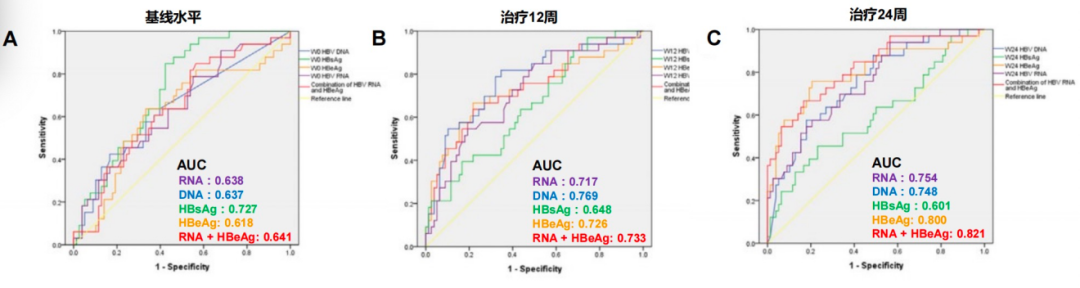
图3. 血清HBV RNA与其他指标在预测NA治疗后的HBeAg血清学转换中的效能比较
目前,关于NA治疗过程中HBeAg血清学转换的临床重要性也受到了挑战。既往人们强调HBeAg血清学转换,主要寄希望于用它来指导停药,然而实际上仅仅用这个指标来指导停药的效果不尽如人意。此外,HBeAg血清学转换对于预测肝癌发生发展、预后的改善也是有限的。更为重要的是,在NA治疗过程中无论是否发生HBeAg血清学转换,并不影响到CHB患者的抗病毒治疗策略,不会因为HBeAg血清学是否转换而去换药或者采取其他的治疗措施。因此,基于血清HBV RNA预测NA治疗后的HBeAg血清学转换的应用前景比较有限。
血清HBV RNA预测NAs停药后复发
目前,关于血清HBV RNA临床应用讨论最为热烈的是其对于NA停药后复发的预测,包括病毒学复发和临床复发。
2016年,我国北京大学医学部鲁凤民教团队率先在JOH上发表了一项小样本(n=33)的回顾性临床研究[6]。采用的停药标准:NA治疗>3年,停药时血清HBV DNA低于检测下限。病毒反弹的定义为:血清HBV DNA在停药后24周转阳。该项研究结果表明,停药时血清HBV RNA阳性的患者,停药后病毒反弹率高。该项研究成果引发了学界对于血清HBV RNA用于指导停药的浓厚兴趣。
我们南方医院团队于2020年在Clin Gastroenterol Hepatol杂志上发表了一项研究[7],首次通过大样本量(n=130)的前瞻性队列证实,血清HBV RNA可有效预测NA停药后的病毒学复发。该项研究结果显示,停药时HBV RNA阴性的患者,停药后4年的累积病毒学复发率显著低于HBV RNA阳性患者;并且依据停药时血清HBV RNA水平可预测停药后病毒反弹(AUC=0.755,图4)。

图4. 研究设计及血清HBV RNA阳性或阴性患者在停药后4年的累积病毒学复发率比较
(引自报告幻灯)
此外,我们团队通过研究发现[8],联合血清HBV RNA及其他指标可以进一步降低停药后临床复发率。该项研究显示,基于既往停药标准(HBV DNA和HBeAg转阴),NA停药后4年累积临床复发率高达30.8%,通过联合HBV RNA,NA停药后4年累积临床复发率降至15.3%;而进一步联合HBV RNA+HBcrAg,NA停药后4年累积临床复发率则为0%(图5)。这项研究提示将HBV RNA、HBcrAg两个指标联合用于预测NA停药后的临床复发具有很好的预测效能。
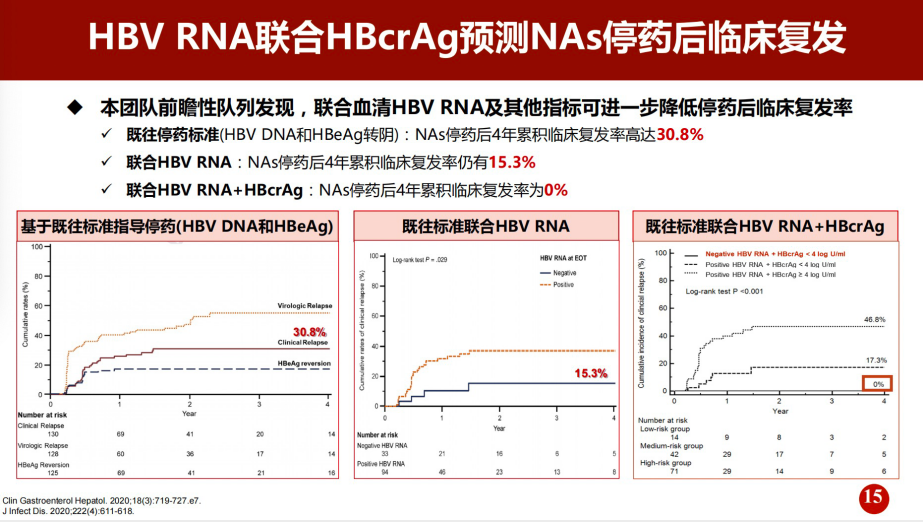
图5. 血清HBV RNA联合其他指标在停药后4年的累积病毒学复发率比较
(引自报告幻灯)
此后,该研究结果也陆续得到了国内外其他团队的研究证实,其中包括2021年我国香港大学袁孟峰教授团队发表在GUT杂志上的一项研究[9],他们发现停药时HBV RNA阴性+HBsAg<10 IU/mL 的患者,NA停药后1年累积病毒学复发率为9.1%,显著低于单独使用HBV RNA或HBsAg水平指导停药的患者(分别为36%~52%和36.7%)。
综上所述,基于目前国内外指南推荐的停药标准[1,10-11],联合HBV RNA指标可进一步降低停药后复发风险。然而,研究表明即使血清HBV RNA转阴,也仍有部分患者会发生复发,可见仍未真正达到“安全”停药的目标。另外,HBV RNA检测方法的灵敏度也是影响其预测NA停药复发效能的重要因素。
血清HBV RNA预测干扰素的抗病毒治疗应答
血清HBV RNA在干扰素治疗应答方面的预测包括HBeAg血清学转换和病毒学应答两方面。早在2018年J Infect Dis杂志发表了一项小样本量研究[12],共纳入76例HBeAg阳性患者,IFN治疗48周,随访至72周,39例为治疗应答者,不应答者37例。结果显示,干扰素治疗基线和治疗12或24周时的血清HBV RNA水平均可用于预测干扰素治疗后的HBeAg血清学转换,并且预测效能比较满意(图6)。

图6. 血清HBV RNA与其他指标在预测干扰素治疗后的HBeAg血清学转换中的效能比较
2020年,北京大学第一医院王贵强教授团队报告了一项基于大样本量的临床研究[13],共纳入727例HBeAg阳性患者,IFN治疗48周,随访至72周,应答者217例,不应答者510例。结果证实,干扰素治疗基线和治疗12周时的血清HBV RNA水平的预测效能多数情况下优于其他HBV标志物(图7)。
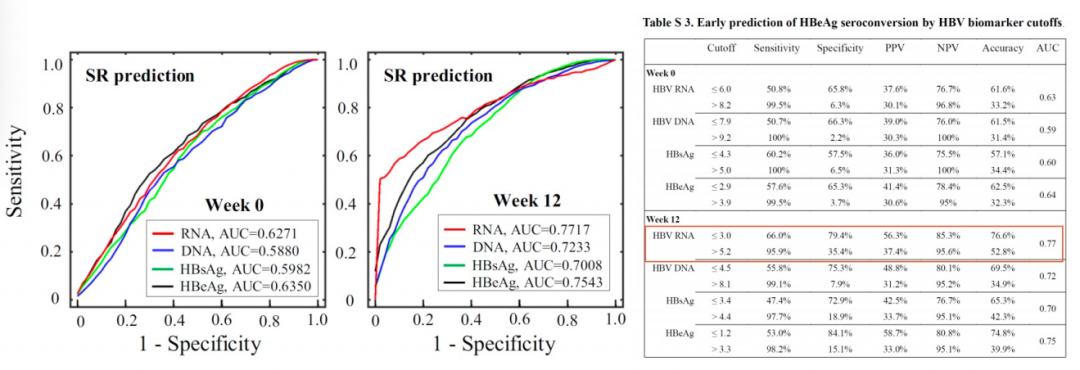
图7. 血清HBV RNA与其他指标在预测干扰素治疗后的HBeAg血清学转换中的效能比较
综上所述,在HBeAg阳性患者中,血清HBV RNA预测HBeAg血清学转换的效能接近或优于传统HBV标志物,但其是否可作为指导干扰素早期停药的标准之一仍有待充分论证。除此之外,研究表明在HBeAg阴性患者中HBV RNA预测IFN治疗应答的效能不如HBsAg定量,其临床应用前景有待进一步探讨。
血清HBV RNA预测肝细胞癌发生发展和术后复发
2021年,上海东方肝胆外科医院周伟平教授团队在Hepatology杂志发表了一项临床研究[14],结果发现对于接受肝细胞癌(HCC)根治性术后的患者,高水平的血清HBV RNA(>2.025 log10 copies/mL)累积复发率较高、总生存率较低、预后较差(图8)。
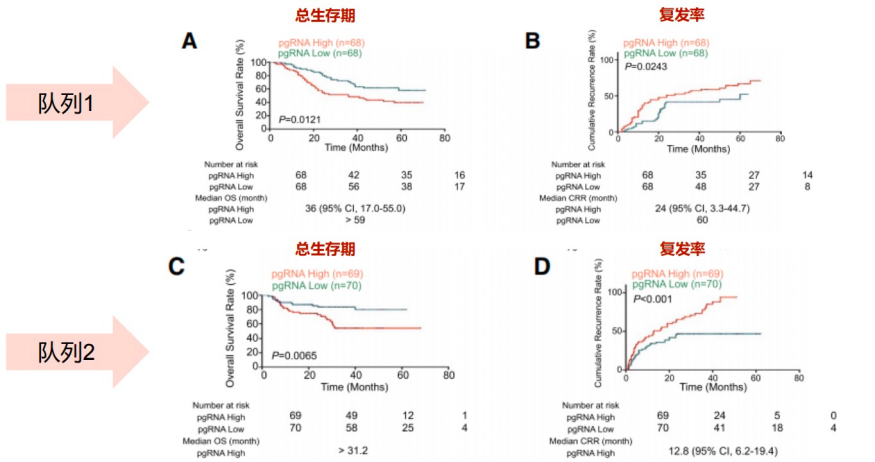
图8. 血清HBV RNA水平与HCC患者累积复发率、总生存率的联系
另一项来自我国香港的小样本病例-对照试验[15],研究纳入接受ETV治疗≥3年,HBV DNA<20 IU/mL(Cobas检测)的CHB患者,匹配因素:年龄、性别、抗病毒治疗时长、肝硬化。结果显示,与未进展至HCC的患者相比,进展至HCC的患者,在发生HCC之前其血清HBV RNA阳性比例明显更高。
我们南方医院团队近期完成了一项关于CHB患者抗病毒治疗相关HCC风险的前瞻性、队列研究[16],共纳入3568例接受NA治疗的CHB患者,中位随访时间4.49(3.68,5.06)年,其中115例发生肝癌。通过校正年龄、性别、肝硬化、抗病毒治疗时长、HBV DNA等病毒因素、肥胖和饮酒等非病毒因素后,我们的研究也证实,相较于血清HBV RNA阴性患者,高水平的血清HBV RNA患者HCC发生风险显著增加(图9)。不过,截至目前我们还没有证据证明在自然人群中,血清HBV RNA与HCC发生风险的相关性。

图9. 高水平的血清HBV RNA患者与HBV RNA阴性患者相比HCC发生风险显著增加
综上所述,在抗病毒治疗人群中,血清HBV RNA与HCC的发生及HCC术后复发之间有一定相关性,特别是HBV DNA转阴的患者中,有更重要的预测价值。因此,为了最大限度降低HCC发生,除了强调HBV DNA转阴,未来也要注意HBV RNA是否转阴。
总 结
总而言之,血清HBV RNA在预测NA停药后复发、预测IFN治疗应答,以及监测肝脏疾病进展(如HCC发生发展)等方面具有重要的潜在应用价值。同时,我们应当注意到其中存在着一些尚未解决的问题,首先,尚无统一的HBV RNA国际标准品和HBV RNA检测方法。其次,目前已知血清中存在着不同存在形式和不同长度的HBV RNA,那么这些不同形式、不同长度的HBV RNA的临床价值是否不同?何种形式的HBV RNA最有价值?NA治疗对不同形式、不同长度的HBV RNA的影响是否存在差异?最后,截至目前,尚未提出基于血清HBV RNA来指导干扰素治疗的一个优化治疗的策略,是否有助于进一步提高患者的疗效?以上这些方面也是未来需要我们深入研究的方向。
参考文献:
1. 慢性乙型肝炎防治指南(2019版). 中华传染病杂志,2019
2. Wang J, Yu Y, Li G, et al. Natural history of serum HBV-RNA in chronic HBV infection. J Viral Hepat. 2018 Sep;25(9):1038-1047.
3. Ghany MG, King WC, Lisker-Melman M, et al. Comparison of HBV RNA and Hepatitis B Core Related Antigen With Conventional HBV Markers Among Untreated Adults With Chronic Hepatitis B in North America. Hepatology. 2021 Nov;74(5):2395-2409.
4. van B?mmel F, Bartens A, Mysickova A, et al. Serum hepatitis B virus RNA levels as an early predictor of hepatitis B envelope antigen seroconversion during treatment with polymerase inhibitors. Hepatology. 2015 Jan;61(1):66-76.
5. Wang X, Wang Z, Chi X, et al. Efficacy of a combination of HBV RNA and HBeAg in predicting HBeAg seroconversion in patients treated with entecavir for 144 weeks. Int J Infect Dis. 2020 Oct;99:171-178.
6. Wang J, Shen T, Huang X, et al. Serum hepatitis B virus RNA is encapsidated pregenome RNA that may be associated with persistence of viral infection and rebound. J Hepatol. 2016 Oct;65(4):700-710.
7. Fan R, Zhou B, Xu M, et al. Association Between Negative Results From Tests for HBV DNA and RNA and Durability of Response After Discontinuation of Nucles(t)ide Analogue Therapy. Clin Gastroenterol Hepatol. 2020 Mar;18(3):719-727.e7.
8. Fan R, Peng J, Xie Q, et al. Combining Hepatitis B Virus RNA and Hepatitis B Core-Related Antigen: Guidance for Safely Stopping Nucleos(t)ide Analogues in Hepatitis B e Antigen-Positive Patients With Chronic Hepatitis B. J Infect Dis. 2020 Jul 23;222(4):611-618.
9. Seto WK, Liu KS, Mak LY, et al. Role of serum HBV RNA and hepatitis B surface antigen levels in identifying Asian patients with chronic hepatitis B suitable for entecavir cessation. Gut. 2021 Apr;70(4):775-783.
10. Terrault NA, Lok ASF, McMahon BJ, et al. Update on prevention, diagnosis, and treatment of chronic hepatitis B: AASLD 2018 hepatitis B guidance. Hepatology. 2018 Apr;67(4):1560-1599.
11. European Association for the Study of the Liver. EASL 2017 Clinical Practice Guidelines on the management of hepatitis B virus infection. J Hepatol. 2017 Aug;67(2):370-398.
12. van B?mmel F, van B?mmel A, Krauel A, et al. Serum HBV RNA as a Predictor of Peginterferon Alfa-2a Response in Patients With HBeAg-Positive Chronic Hepatitis B. J Infect Dis. 2018 Aug 24;218(7):1066-1074.
13. Zhang M, Li G, Shang J, et al. Rapidly decreased HBV RNA predicts responses of pegylated interferons in HBeAg-positive patients: a longitudinal cohort study. Hepatol Int. 2020 Mar;14(2):212-224.
14. Ding WB, Wang MC, Yu J, et al. HBV/Pregenomic RNA Increases the Stemness and Promotes the Development of HBV-Related HCC Through Reciprocal Regulation With Insulin-Like Growth Factor 2 mRNA-Binding Protein 3. Hepatology. 2021 Sep;74(3):1480-1495.
15. Mak LY, Huang Q, Wong DK, et al. Residual HBV DNA and pgRNA viraemia is associated with hepatocellular carcinoma in chronic hepatitis B patients on antiviral therapy. J Gastroenterol. 2021 May;56(5):479-488.
16. Liu S, Deng R, Zhou B, et al. Association of serum hepatitis B virus RNA with hepatocellular carcinoma risk in chronic hepatitis B patients under nucleos(t)ide analogues therapy. J Infect Dis. 2021 Dec 21:jiab597. Epub ahead of print.

标签:
研究
热点聚焦
肝癌
发表评论
全部评论
