江家骥教授、郑琦教授:抗病毒时代,PegIFNα改善HBV相关HCC的临床结局——新视角、新证据
—— 作者: 时间:2022-07-23
阅读数:
47
编者按:原发性肝癌是目前我国第4位常见恶性肿瘤及第2位肿瘤致死病因,严重威胁我国人民的生命和健康。而HBV感染是我国这一疾病的最主要致病因素。在针对HBV感染的抗病毒治疗时代,HBV相关肝癌的发生是否因此得到控制,HBV相关肝癌患者的临床结局是否得到改善?
在2022年7月1~3日举办的“第十五届全国肝脏疾病临床学术大会暨第五届华夏肝脏病学联盟年会”上,福建医科大学附属第一医院肝病中心郑琦教授发表了题为“抗病毒时代,PegIFNα改善HBV相关HCC的临床结局”的精彩报告,她结合新证据,从新视角,分享了抗病毒治疗带来的最新生存获益。《国际肝病》特此报道,相关内容整理如下。
1
抗病毒治疗时代影响肝癌复发的危险因素
世界卫生组织(WHO)的国际癌症机构(IARC)公布2020年全球癌症死亡病例数,肝癌仍位列第五;中国肝癌死亡病例数39.12万例,高居第2位[1]。中国原发性肝癌临床登记调查(CLCS)调研结果显示中国原发性肝癌患者中乙肝感染率高达92.05%,乙肝感染仍然是肝癌最主要的致病因素[2]。原发性肝癌的一级预防,特别是乙肝疫苗接种、母婴阻断,已经大大降低乙肝感染;而抗病毒治疗的二级预防也很大程度上降低了肝癌的发生。但是肝癌的复发转移仍然给肝癌远期疗效带来严峻挑战。
乙型肝炎病毒(Hepatitis B virus,HBV)相关肝细胞癌(Hepatocellular carcinoma,HCC)根治术前是否行抗病毒治疗影响其术后远期疗效,术前接受抗病毒治疗者的1年、3年和5年复发率分别为24.7%、50.7%和57.9%,而术前未接受抗病毒治疗者的复发率分别为37.1%、61.5%和70.8%(P<0.001)[3],详见图1。此外,影响HBV相关HCC复发的病毒因素有高HBV DNA、高乙肝表面抗原(Hepatitis B surface antigen,HBsAg)、高前基因组RNA(pregenomic RNA,pgRNA)以及病毒导致的肝炎活动。
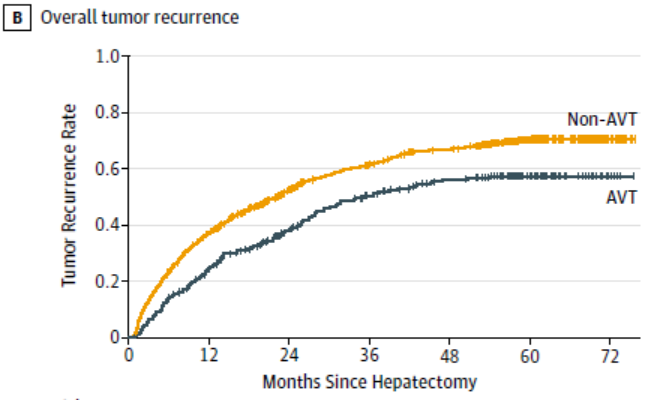
图1. HBV-HCC根治术前是否行抗病毒治疗的术后复发率
有研究发现HCC切除前HBsAg>1000 IU/ml的患者的总生存时间(OS)和无病生存期(DFS)均低于HBsAg<1000 IU/ml的患者[分别是OS,57.5% vs. 48.8%(P=0.004);DFS,46.1% vs. 34.1%(P= 0.002)][4]。另一项研究发现cccDNA(covalently closed circular DNA)、pgRNA以及治疗状况和微血管浸润与生存率相关,高pgRNA水平组,总体生存率低于低pgRNA组,而总复发率高于低pgRNA组[5]。术前血清pgRNA水平是判断血清HBV DNA阴性HBV相关HCC患者预后的标志物[6]。
2
在抗病毒治疗时代,IFNα(Interferon-α)更好地降低肝癌术后复发
干扰素因其同时具有抗血管生成、抗HCC细胞增殖、促进肿瘤细胞凋亡、直接作用乙肝共价闭合环状DNA(covalently closed circular DNA,cccDNA)和pgRNA、分泌抗HBV病毒蛋白的机制,目前已被广泛接受应用于肝癌术后的患者。
复旦大学中山医院研究了568例根治性手术患者,其中101例接受IFNα治疗;发现术后IFN-α治疗是总体生存率的独立因素,HBV相关HCC根治性切除术后IFN-α治疗可以提高肝癌术后总体生存率[7]。PEG IFNα联合核苷(酸)类似物(NA)治疗,显著提高HBV-HCC根治性切除/消融术后8年生存率。尤其是早期联合治疗组的8年总生存率显著高于晚期联合治疗组和NA单药治疗组(P<0.05)[8],详见图2。
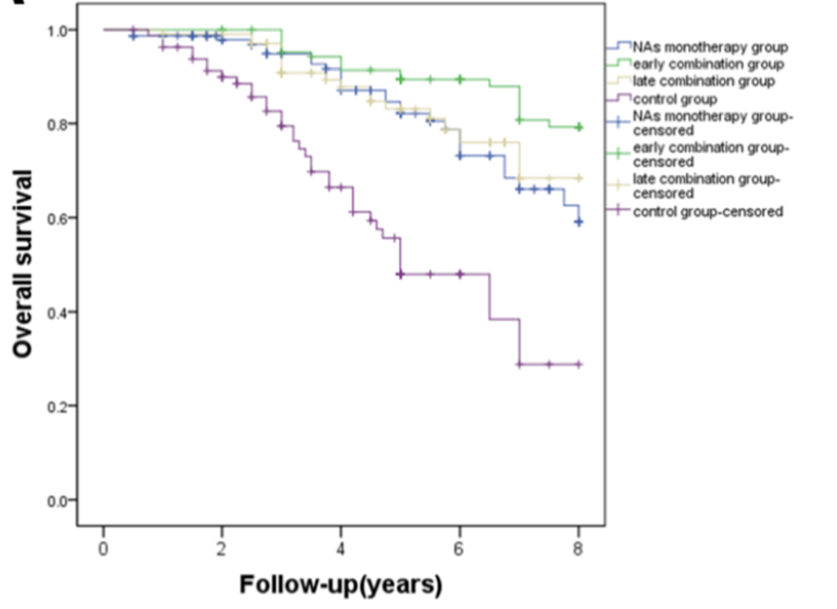
图2.早期联合治疗组的8年总生存率显著高于晚期联合治疗组和VA单药治疗组
对于不能根治的HCC患者,干扰素治疗仍能获益。一项研究将216例不可切除的HBV-HCC患者随机分为TACE组和TACE-IFN组,每组108例;在TACE-IFN组中,患者在TACE治疗前后1周开始注射干扰素(IFN α 3MU i.m tiw 18个月);TACE-IFN组对比TACE组,DFS为23.6 vs 20.3个月(P=0.027),中位OS为29 vs. 26个月,治疗后2年生存率为72.2% vs. 52.8%(P=0.003);该研究结果证实了TACE联合干扰素α治疗可减少HCC复发,延长生存[9]。
3
IFNα降低肝癌复发的作用机制
01
IFNα通过改善肝癌周围组织的机械(力学)生物学,从而改善肝癌的临床结局
实验证实肝脏硬度在HCC发生发展中占有重要位置。较高的肝脏硬度会促进体内HCC的生长和转移,会改变恶性表型并诱导HCC细胞上皮间质转化(Epithelial-Mesenchymal transition,EMT),可诱导和增强HCC细胞的干性特征,从而促进肝癌细胞增殖和侵袭[10]。
随着肝硬化、肝癌的形成,肝脏的基质沉积、窦周压力增加以及胶原纤维形成,肝癌周围组织的机械(力学)生物学概念被提出。组织硬度的变化导致与细胞和细胞外基质的机械特性相关的“机械信号通路”的改变[11]。其通过转录生长因子(Transforming growth factor-β,TGF-β)促进EMT、导致肿瘤相关的纤维母细胞形成和肿瘤转移(图3)。

图3.TGF-β促进EMT、导致肿瘤相关的纤维母细胞形成和肿瘤转移
临床研究进一步证实肝脏硬度值(liver stiffness measurement,LSM)是肝癌术后预后的重要指标,术后LSM的变化与患者的OS、DFS和复发密切相关。而IFN-α具有明确的抗纤维化作用,IFN-α通过抑制TGF-β的产生、降低HSC活化、刺激HSC体外凋亡而表现出抗纤维化活性,进而改善肝癌的临床结局[12]。
02
IFNα通过重新编辑肝癌细胞的糖酵解信号、增强肿瘤浸润免疫细胞,从而抑制肝癌细胞的生长
Hongyan Diao等研究发现miRNA-30b-5p与MINPP1是参与糖酵解/糖异生途径的靶基因,两者呈负相关、存在潜在的调控关系[13]。
MINPP1通过糖酵解旁路途径降低葡萄糖的消耗、乳酸的产生以及2,3-双磷酸甘油酸(2,3-BPG),从而抑制HBV相关HCC的发生发展。Hep3B细胞转染了miRNA-30b-5p抑制剂时,肿瘤的生长、体积以及重量都受到明显抑制,证实miRNA-30b-5p对HBV相关HCC细胞具有促进作用并通过抑制抑癌基因MINPP1的表达来发挥其致癌作用[13]。
HBV编码的P蛋白是通过转录因子FOXO3调节miRNA-30b-5p/MINPP1表达的关键因子,通过与FOXO3的相互作用促进miRNA-30b-5p的表达。MINPP1能够抑制肿瘤细胞生长,而miRNA-30b-5p能抑制MINPP1表达,上调miRNA-30b-5p的表达促进HCC细胞生长[13],详见图4。

图4. HBV编码的P蛋白通过FOXO3/miRNA-30b-5p/ MINPP1轴启动糖酵解旁路促进HBV相关肝细胞癌的发展
03
IFN-α+PD-1阻断联合治疗活化mTOR-FOXM1信号通路,重塑了T细胞活化所必需的高糖微环境,通过mTOR诱导T细胞中FOXM1的表达进而促进T细胞共刺激分子(CD27)的转录与表达
复旦大学樊嘉院士、朱棣教授等研究发现阻断PD-1能够促进肿瘤细胞中的HIF1α信号通路促进肿瘤细胞糖酵解,促进肿瘤细胞,IFNα诱导IRF1表达,导致FosB转录失活,进一步减弱了HIF1α的转录活性,进而导致HCC细胞中糖酵解相关基因的表达下调,抑制肿瘤细胞糖酵解[14]。另一方面CD27highCD8+T细胞高表达FOXM1,FOXM1的过表达能进一步促进CD27的转录。
IFN-α联合PD-1阻断治疗后肿瘤组织中CD27+CD8+T细胞的富集和浸润显著增加,导致CD8+T细胞摄取葡萄糖的能力增强,从而促进其增殖和分化。在CD27高表达的CD8+T细胞中,PD-1的表达也升高,会产生“刹车效应”。而干扰素α对PD-1抗体的增敏作用增强了CD8+T细胞的免疫杀伤能力,刹车效应解除,可更好地杀伤HCC细胞。(图5)动物实验与临床实践均证实,IFNα联合PD-1抗体对PD-1抗体治疗无反应的HBV-HCC患者取得了令人鼓舞的效果。

图5.干扰素α抑制肿瘤细胞的葡萄糖代谢并增加T细胞的糖酵解,从而促进PD-1抗体诱导的免疫应答,提高T细胞的免疫杀伤能力
总体而言,无论是理论机制还是临床研究,均证实IFN-α可以减少肝癌复发、延长生存时间。
参考文献:
[1] Latest global cancer data: Cancer burden rises to 19.3 million new cases and 10.0 million cancer deaths in 2020.https://www.iarc.fr/fr/news-events/latest-global-cancer-data-cancer-burden-rises-to-19-3-million-new-cases-and-10-0-million-cancer-deaths-in-2020/
[2] 秦叔逵,中国原发性肝癌临床登记调查(CLCS)的中期报告,2019 CSCO
[3] Li Z, Lei Z, Xia Y, et al. Association of Preoperative Antiviral Treatment With Incidences of Microvascular Invasion and Early Tumor Recurrence in Hepatitis B Virus-Related Hepatocellular Carcinoma [J]. JAMA Surg, 2018, 153(10): e182721.
[4] Huang G, Lau WY, Zhou WP, et al. Prediction of Hepatocellular Carcinoma Recurrence in Patients With Low Hepatitis B Virus DNA Levels and High Preoperative Hepatitis B Surface Antigen Levels [J]. JAMA Surg, 2014, 149(6): 519-527.
[5] Halgand B, Desterke C, Riviere L, et al. Hepatitis B Virus Pregenomic RNA in Hepatocellular Carcinoma: A Nosological and Prognostic Determinant [J]. Hepatology, 2018, 67(1): 86-96.
[6] Ding WB, Wang MC, Yu J, et al. HBV/Pregenomic RNA Increases the Stemness and Promotes the Development of HBV-Related HCC Through Reciprocal Regulation With Insulin-Like Growth Factor 2 mRNA-Binding Protein 3 [J]. Hepatology, 2021, 74(3): 1480-1495.
[7] Qu LS, Jin F, Huang XW, et al. Interferon-alpha therapy after curative resection prevents early recurrence and improves survival in patients with hepatitis B virus-related hepatocellular carcinoma [J]. J Surg Oncol, 2010, 102(7): 796-801.
[8] Qi W, Zhang Q, Xu Y, et al. Peg-interferon and nucleos(t)ide analogue combination at inception of antiviral therapy improves both anti-HBV efficacy and long-term survival among HBV DNA-positive hepatocellular carcinoma patients after hepatectomy/ablation [J]. J Viral Hepat, 2020, 27(4): 387-396.
[9] Li M, Lu C, Cheng J, et al. Combination therapy with transarterial chemoembolization and interferon-alpha compared with transarterial chemoembolization alone for hepatitis B virus related unresectable hepatocellular carcinoma [J]. J Gastroenterol Hepatol, 2009, 24(8): 1437-1444.
[10] Dong Y, Zheng Q, Wang Z, et al. Higher matrix stiffness as an independent initiator triggers epithelial-mesenchymal transition and facilitates HCC metastasis [J]. J Hematol Oncol, 2019, 12(1): 112.
[11] Passi M, Zahler S. Mechano-Signaling Aspects of Hepatocellular Carcinoma [J]. J Cancer, 2021, 12(21): 6411-6421.
[12] Jung YK, Yim HJ. Reversal of liver cirrhosis: current evidence and expectations [J]. Korean J Intern Med, 2017, 32(2): 213-228.
[13] Chen W, Jiang J, Gong L, et al. Hepatitis B virus P protein initiates glycolytic bypass in HBV-related hepatocellular carcinoma via a FOXO3/miRNA-30b-5p/MINPP1 axis [J]. J Exp Clin Cancer Res, 2021, 40(1): 1.
[14] Hu B, Yu M, Ma X, et al. IFNalpha Potentiates Anti-PD-1 Efficacy by Remodeling Glucose Metabolism in the Hepatocellular Carcinoma Microenvironment [J]. Cancer Discov, 2022, 12(7): 1718-1741.

专家简介
郑琦
福建医科大学附属第一医院肝病中心科副主任
医学博士,主任医师,博士生导师
福建医科大学肝病研究所副所长
中华医学会肝病学分会肝癌学组委员
中国医师协会感染科医师分会委员
福建省医师协会感染科分会副会长
福建省医学会肝病学分会委员兼秘书
美国斯坦福大学访问学者
承担及参与国家重大科技专项、福建省重大科技专项、福建省自然科研基金、福建省卫生厅科研基金及福建省教育厅的课题资助
获得福建省医学科技奖二等奖及福建省科技进步奖三等奖

专家简介
江家骥
福建医科大学附属第一医院教授、主任医师、博士生导师
1982年毕业于福建医科大学,1995年于法国巴黎第五大学Cochin医学院取得博士学位。2000至2001年在法国Boul Brousse 医院工作。

标签:
研究
专家访谈
肝癌
发表评论
全部评论
