名家视点丨杨正强教授:2022年结直肠癌肝转移治疗进展
—— 作者: 时间:2022-08-19
阅读数:
100
编者按:2022年国家癌症中心发布我国癌症发病最新数据,其中结直肠癌的新发病例和死亡病例分别位列所有瘤种的第2位和第4位[1]。肝脏是结直肠癌血行转移最主要的靶器官,中国结直肠癌患者中43.8%在确诊时即合并转移,其中肝转移占比超过半数,而另有8.1%~12.8%患者在结直肠癌原发灶根治术后可发生肝转移[2],其中绝大多数的肝转移灶初始无法获得根治性切除。本期《国际肝病》特邀中国医学科学院肿瘤医院杨正强教授,就结直肠癌肝转移治疗最新进展作前沿解读。
结直肠癌肝转移诊疗路径:
COLLISION vs. 中国共识
结直肠癌肝转移(CRLM)是结直肠癌患者最主要的死亡原因:初诊时合并有肝转移的结肠癌和直肠癌患者的中位OS分别为10个月和13个月[3],肝转移患者的预后次于肺转移,但好于其他部位转移[4],详见图1。对于肝转移病灶无法切除的患者,5年生存率<5%,而肝转移灶完全切除患者的中位生存期为35个月,5年生存率为30%~57%[5]。以上生存结果提示,为结直肠癌肝转移患者提供正确的诊疗路径,能使患者获得更好的生存获益。
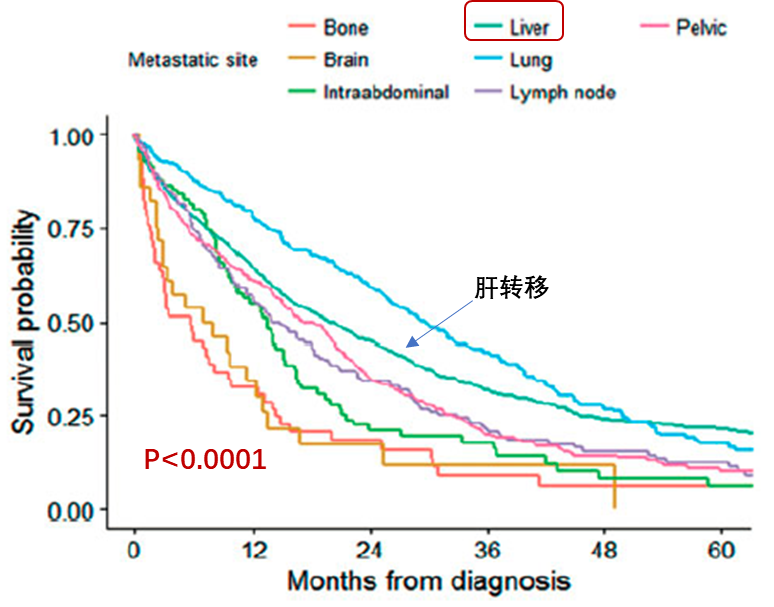
图1.比较结直肠癌单个部位转移病变的OS分析[4]
ESMO结直肠癌肝转移治疗策略建议治疗目标应达到“无疾病证据(NED)”状态,治疗原则推荐为全身治疗联合局部治疗[6]。COLLISION研究组专家共识针对结直肠癌单纯合并有肝转移的患者提出了明确的诊疗路径:①从患者特征出发[7],易于切除/消融的IVa期CRLM以及部分难以切除/消融的IVb期CRLM,推荐根治性切除和/或消融且不需要接受辅助化疗;而对于部分IVb期、全部的IVc期和IVd期CRLM患者,需依据化疗是否获益、早期异时性、肝脏转移病灶数量和大小、残余肝体积以及是否适合肝移植等角度综合判断,选择根治性切除和/或消融,或全身姑息治疗,详见图2。②从肿瘤特征出发[7],依据肿瘤大小、解剖学位置、手术/消融禁忌选择不同的治疗方法,详见图3。
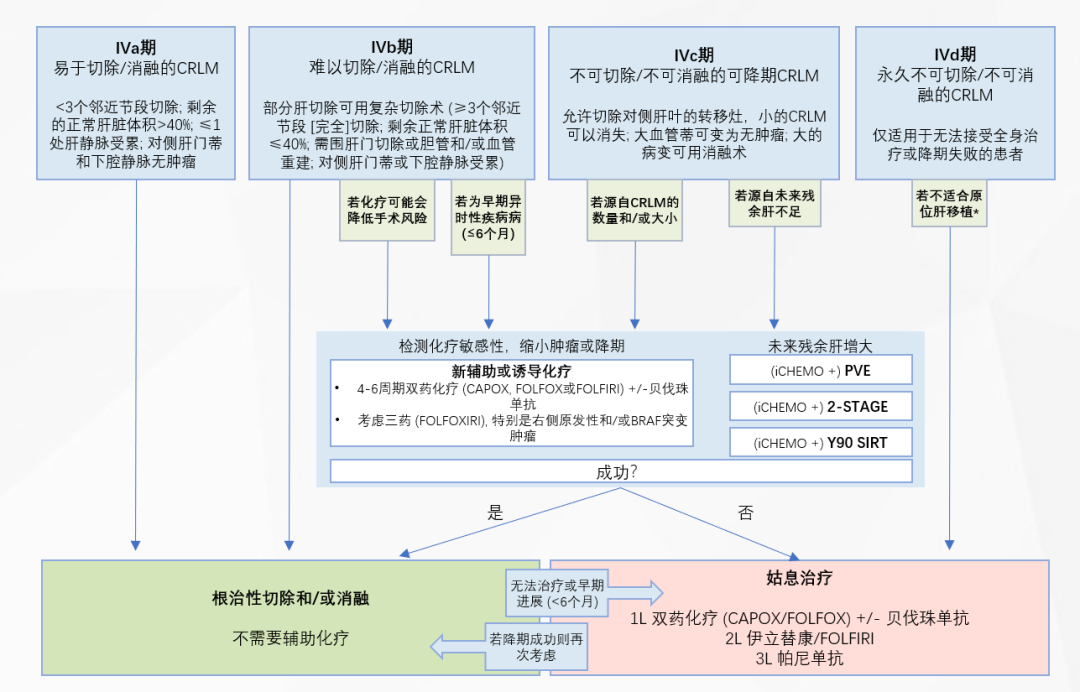
图2.结直肠癌肝转移可切除性和消融性标准——患者特征[7]
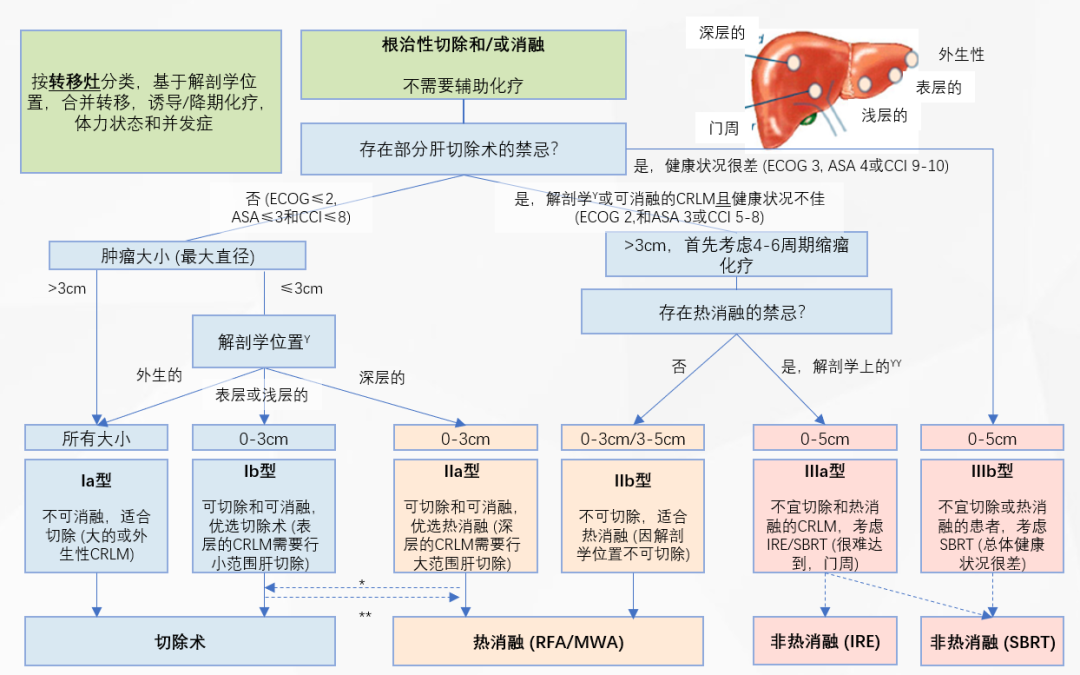
图3.结直肠癌肝转移可切除性和消融性标准——肿瘤特征[7]
《中国结直肠癌肝转移诊断和综合治疗指南(2020)》[8]建议依据结直肠癌确诊时合并肝转移病灶是否可切除,选择不同治疗方式:①肝转移病灶可切除时,在同步或分阶段切除肝转移病灶的同时,选择对晚期结直肠癌肝转移有效的化疗方案、或肝动脉灌注治疗±全身化疗。②肝转移病灶不可切除时,通过全身治疗尝试进行转化治疗,当仍不可切除时考虑全身系统治疗。详见图4。
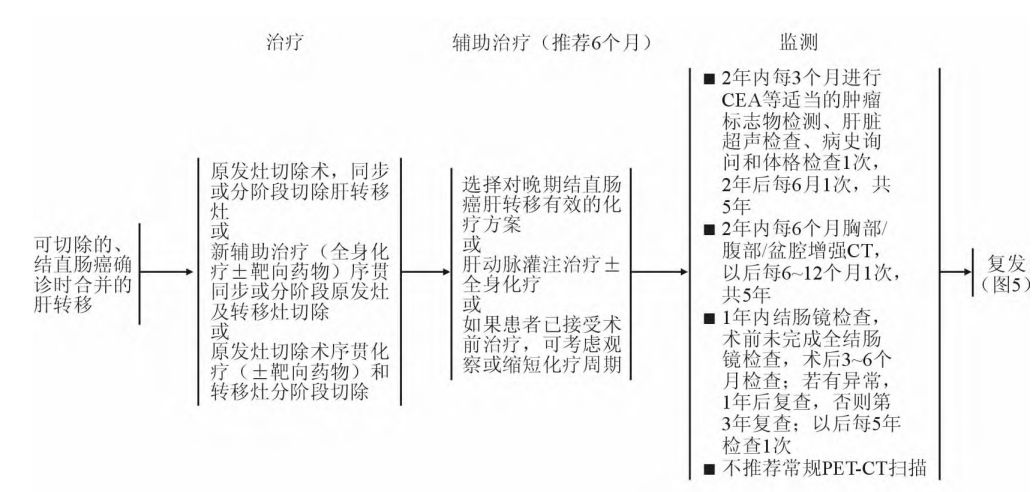
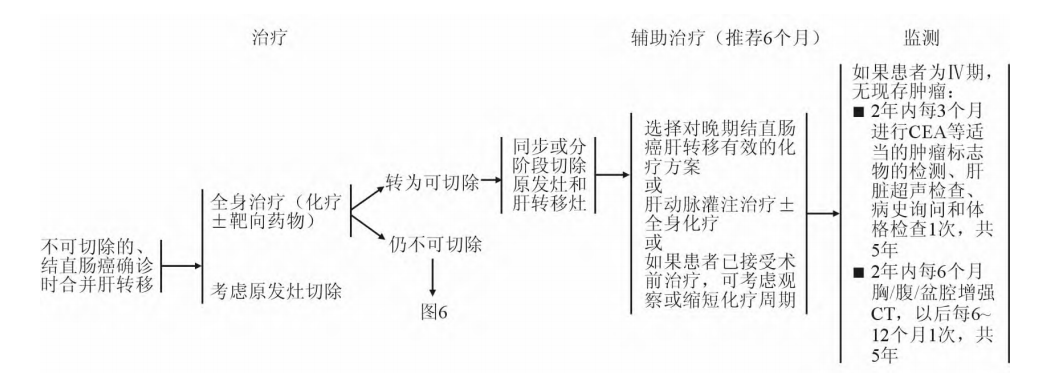
图4.结直肠癌确诊时合并肝转移的治疗
(上图:转移灶可切除;下图:转移灶不能切除)[8]
结直肠癌肝转移局部治疗之争:
射频消融 vs. 手术切除
约60%的结直肠癌患者会出现肝转移,仅有10%~25%的CRLM在初诊时可通过手术切除[9],因此,以射频消融(RFA)为代表的局部消融技术可以使更多的患者有机会达到NED状态,提高长期生存。CRLM的经皮消融手术指征包括:单个转移灶<5 cm;多发性肝转移时,肿瘤数目≤3个,其中最大肿瘤的直径≤3 cm;有4~8个多发转移灶,最大肿瘤直径<4 cm,可分批消融;消融后复发或出现新转移灶[10]。
多项研究表明,RFA对CRLM的治疗相较于手术切除,近期并发症较少,但在肿瘤复发、无复发生存以及总生存期的疗效方面逊色于手术治疗[11-13]。对于CRLM转移灶位置特殊、不适宜手术的患者人群,RFA是一种适宜、安全且有效的治疗可选方式。影响RFA疗效的主要因素包括:肿瘤>3 cm、消融边缘没有达到5 mm以上、消融边缘残余肿瘤细胞以及Kras基因突变。当前仍缺乏前瞻性随机对照研究,头对头比较RFA与手术切除在CRLM人群中的疗效,期待更多研究结果的不断出炉,为CRLM提供最优治疗路径。
结直肠癌肝转移:
局部联合系统、靶向协同免疫
随着对结直肠癌发病机制的深入研究和精准医学的发展,发现了越来越多的与结直肠癌发病和治疗相关的基因,生物标志物的检测目前已成为晚期结直肠癌临床治疗实践中的重要内容,同时直接影响了晚期结直肠癌的规范治疗。目前与结直肠癌发病相关性明确的生物标志物包括RAS、MSI/MMR和BRAF等。在CRLM人群中的常见生物学标志物、检测阳性率及预后意义总结如下,详见表1。
表1.结直肠癌肝转移的生物学特点及其预后意义

全身化疗是CRLM人群的重要基础治疗,在一线全身化疗方案的基础上,是应用双药还是三药方案,是联合抗VEGF还是联合抗EGFR,以及序贯治疗方案的选择仍需进一步进行探索。而免疫检查点抑制剂在中期MSI-H的直肠癌患者中显示出根治性潜力,提示通过生物标志物筛选,可以进一步提升免疫检查点抑制剂在结直肠癌患者中的疗效。而以介入为代表的局部治疗如何更好联合全身系统性治疗,需要更多研究进一步证实。
总 结
结直肠癌是发病率逐年升高的恶性肿瘤,消融、肝动脉导管途径给药在结直肠癌肝脏转移的治疗中有重要的角色,熟悉化疗、靶向和免疫等系统治疗,有助于介入医生更好地进入CRLM领域。

专家简介
杨正强
中国医学科学院肿瘤医院,介入治疗科,医学博士、主任医师、博士研究生导师。
曾在美国克利夫兰医学中心、韩国首尔峨山医院访问留学。长期从事各种良、恶性肿瘤的介入放射治疗工作,擅长采用微创方法,治疗胸部、腹部和盆腔等多部位的恶性肿瘤。尤其擅长肝、胆、胰和消化道恶性肿瘤的综合治疗。
兼任中国抗癌协会,微创治疗专业委员会,常务委员;中国抗癌协会,肿瘤消融专业委员会,常务委员;中国妇幼保健协会,介入放射专委会,常务委员;世界华人肿瘤医师协会,微创介入专业委员会,常务委员;北京肿瘤学会,介入治疗专委会,秘书长;国家药品监督管理局药品评价中心学术委员会,委员;中华医学会放射学分会,胃肠道及胰腺疾病专委会,委员;《中华介入放射学杂志》编委;《中华消化病与影像杂志》编委。承担国家级、省部级科研课题及临床转化医学研究项目多项,指导博士、硕士研究生20余名。
参考文献:
1. Zheng, R., et al., Cancer incidence and mortality in China, 2016. Journal of the National Cancer Center, 2022.
2. Xu, R., et al., Disease characteristics and treatment patterns of Chinese patients with metastatic colorectal cancer: a retrospective study using medical records from China. BMC cancer, 2020. 20(1): p. 1-10.
3. Horn, S.R., et al., Epidemiology of liver metastases. Cancer epidemiology, 2020. 67: p. 101760.
4. Prasanna, T., et al., The survival outcome of patients with metastatic colorectal cancer based on the site of metastases and the impact of molecular markers and site of primary cancer on metastatic pattern. Acta Oncologica, 2018. 57(11): p. 1438-1444.
5. 中国医师协会外科医师分会, et al., 中国结直肠癌肝转移诊断和综合治疗指南(2020版). 中国实用外科杂志, 2021. 41(1): p. 11.
6. Van Cutsem, E., et al., ESMO consensus guidelines for the management of patients with metastatic colorectal cancer. Annals of Oncology, 2016. 27(8): p. 1386-1422.
7. Nieuwenhuizen, S., et al., Resectability and Ablatability Criteria for the Treatment of Liver Only Colorectal Metastases: Multidisciplinary Consensus Document from the COLLISION Trial Group. Cancers, 2020. 12(7): p. 1779.
8. 中国医师协会外科医师分会, et al., 中国结直肠癌肝转移诊断和综合治疗指南(2020). 中国临床医学, 2021. 28(1): p. 16.
9. Ungureanu, B.S., et al., Surgical hepatic resection vs. ultrasonographic guided radiofrequency ablation in colorectal liver metastases: what should we choose? Medical Ultrasonography, 2014. 16(2): p. 145-51.
10. Chen MH, L.P., Chinese interventional ultrasound. PMPH, 2017.
11. van Amerongen, M.J., et al., Radiofrequency ablation compared to surgical resection for curative treatment of patients with colorectal liver metastases–a meta-analysis. Hpb, 2017. 19(9): p. 749-756.
12. Yang, G., et al., The prognosis of radiofrequency ablation versus hepatic resection for patients with colorectal liver metastases: a systematic review and meta-analysis based on 22 studies. International Journal of Surgery, 2021. 87: p. 105896.
13. Wang, L.-J., et al., Radiofrequency ablation versus resection for technically resectable colorectal liver metastasis: a propensity score analysis. World Journal of Surgical Oncology, 2018. 16(1): p. 1-8.

标签:
循证视点
专家访谈
其他肝病
发表评论
全部评论
