范建高教授:细说代谢综合征、脂肪肝与肿瘤的因果关联
—— 作者: 时间:2022-09-21
阅读数:
119
随着肥胖和糖尿病在全球的流行,非酒精性脂肪性肝病(NAFLD)正成为最常见的慢性肝脏疾病。但事实上,NAFLD是一种代谢综合征累及肝脏的病理改变,胰岛素抵抗和代谢功能障碍是NAFLD的重要发病机制。2020年国际专家小组提出将NAFLD更名为代谢相关脂肪性肝病(MAFLD)。新的定义采用肯定性而非排他性诊断方法,将防治肥胖、糖尿病以及代谢功能障碍提到前台,为临床诊断思维模式和疾病防治打开了新的格局。

在近日举办的第十五届北京感染病和肝病论坛学术活动上,NAFLD更名工作参与者、上海交通大学医学院附属新华医院消化内科主任范建高教授对“代谢综合征、脂肪肝及其相关恶性肿瘤”这一主题进行深入的分享和探讨。《国际肝病》特此报道,将精彩内容分享如下。
代谢综合征的工作定义与时俱进
代谢综合征最早是1989年在心脏病学领域出现,当时被称为“死亡四重奏” [1]。研究显示,代谢综合征是动脉硬化性心血管疾病危险因素聚集的状态,包括肥胖、高血糖、甘油三酯增高、高密度脂蛋白下降以及高血压等。后来随着全球肥胖的流行,代谢综合征越来越受到重视,该疾病的诊断标准也在不断进展。
代谢综合征的工作定义(以胰岛素抵抗或高血糖为中心)最早由世界卫生组织(WHO)于1999年提出[2],而后许多国家和学术组织都制定了各自的代谢综合征诊断标准并不断更新。2001年,美国国家胆固醇教育(NCEP)计划成人治疗方案第三次报告(ATP Ⅲ)在WHO标准上简化了代谢综合征的工作定义[3],取消了糖尿病或胰岛素抵抗的必需条件;2005年,国际糖尿病联盟(IDF)提出[4],尽管不再强调胰岛素抵抗,但代谢综合征的核心标准仍为中心性肥胖,在此基础上再评估血脂、血压、血糖等水平。此外,美国国立心肺血液研究所(NHLBI,2005年)、国际糖尿病联盟(IDF,2005年)和IDF流行病预防工作组联合过渡声明(JIS,2009年)标准也相继发布。
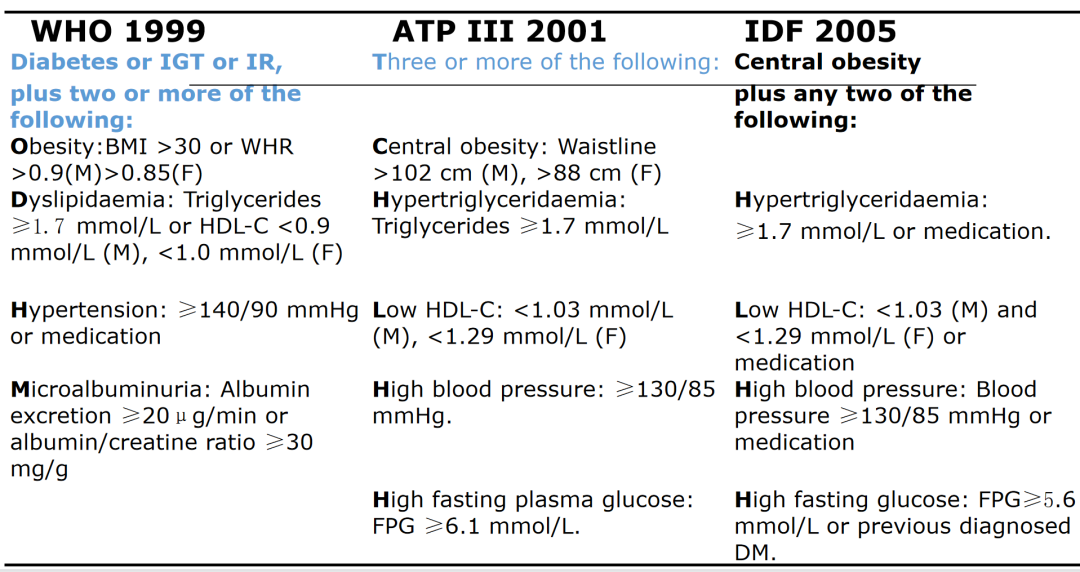
图1 不同版本代谢综合征工作定义对比
(引自讲者幻灯)
有研究发现[5],根据NHLBI标准诊断代谢综合征及其组分,只有2%~3%的亚洲人按照西方标准被列为肥胖;与同样体重指数(BMI)的白种人相比,亚洲人内脏脂肪更多,瘦体重更少。因此,亚洲研究采用了肥胖/中心型肥胖和代谢综合征的区域标准,数据发现亚洲人代谢综合征患病率并不比欧洲人低,诊断标准亟需改变。因此,中国也尝试建立自己的诊断标准,2004年中华医学会糖尿病学分会(CDS)建立了中国第一个代谢综合征标准,2007年中国成人血脂异常防治指南制定联合委员会(JCDCG)在CDS 2004的标准上,提出了JCDCG 2007标准[6]。改良版代谢综合征工作定义更符合亚洲人的流行病学特征。
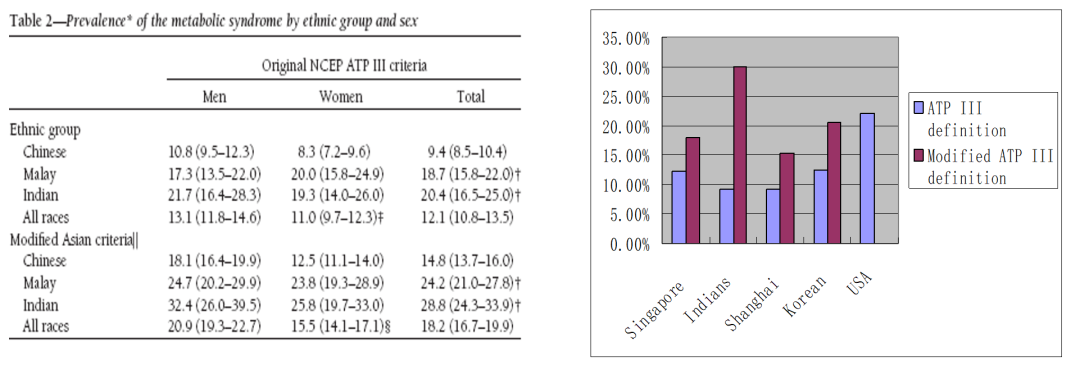
图2 亚洲代谢综合征发病率
(引自讲者幻灯)
代谢综合征与NAFLD互为因果
现有的临床流行病学研究表明,代谢综合征除了与2型糖尿病互为因果外,也与NAFLD、尤其是非酒精性脂肪性肝炎(NASH)也相互影响。NAFLD是与遗传易感和代谢功能障碍相关的脂肪性肝病,涉及的疾病谱包括非酒精性单纯性脂肪肝、NASH及其相关肝硬化和肝癌。
来自国内外大量研究数据显示[7-8],NAFLD时肝脏脂肪沉积可直接诱发氧化应激和肝脏炎症损伤。脂肪肝患者在血液转氨酶升高之前,更常出现的是血脂、血糖、血压、尿酸的升高。因此,患者往往伴有动脉粥样硬化或其他心脑血管疾病;脂肪肝导致的肝脏不良结果往往发生在疾病后期(可能需要三四十年),在肝癌发生之前可能已经发生了心血管事件、以及结直肠肿瘤、乳房癌或肺部腺癌等肝外肿瘤。
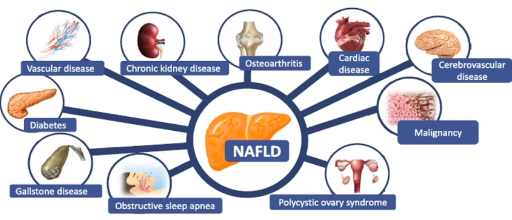
图3 非酒精性脂肪性肝病相关疾病谱
(引自讲者幻灯)
NAFLD相关肝细胞癌的疾病进程
随着肥胖和糖尿病在全球的流行,NAFLD正成为最常见的慢性肝脏疾病,累及25%左右的成人,其中25%进展为NASH,NASH中又有25%可能进一步发展为肝硬化和肝癌[9]。NAFLD已经成为当今全球肝硬化和肝癌发病人数或死亡人数不断增加的重要原因。数据显示,2017年全球肝细胞癌和肝硬化死亡患者中NAFLD的占比已达到8%以上,值得注意的是,这一数字可能还会升高。因此,美国胃肠病学会强调,对于有进展期肝病、特别伴有肝硬化的NAFLD患者,应加强肝癌筛查。
通常我们以为NAFLD相关肝癌的疾病进程是从脂肪性肝炎、进展期肝纤维化和肝硬化,进而发生肝癌。但实际上,肥胖、代谢综合征、2型糖尿病相关NAFLD的任何一个阶段都可导致肝癌进展,只是发生肝硬化时癌变的风险最强。
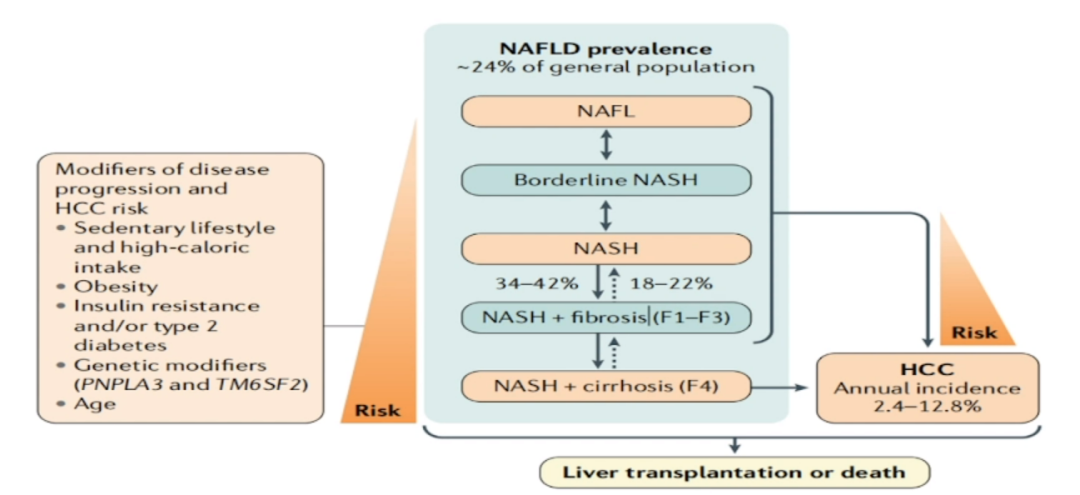
图4 NAFLD相关HCC的疾病进程
(引自讲者幻灯)
目前认为,NAFLD相关肝癌的发病机理主要为代谢功能障碍、氧化应激、胰岛素抵抗、脂毒性以及代谢性炎症和肠肝轴紊乱。有研究显示[10],肥胖性脂肪肝导致的脂肪性肝炎和肝癌是通过不同的路径,分别为STAT-1途径和STAT3途径。这就意味着仅缓解脂肪性肝炎和肝硬化的进展未必能完全减少肝癌的发生。《新英格兰医学杂志》早在2003年就报道,肥胖可以增加几乎所有肿瘤相关死亡,不仅肝癌,还有前列腺癌、非霍奇金淋巴瘤、胰腺癌、胃癌等。因此,重视癌症的预防可以从防控肥胖开始。

图5 NAFLD相关HCC的疾病进程
(引自讲者幻灯)
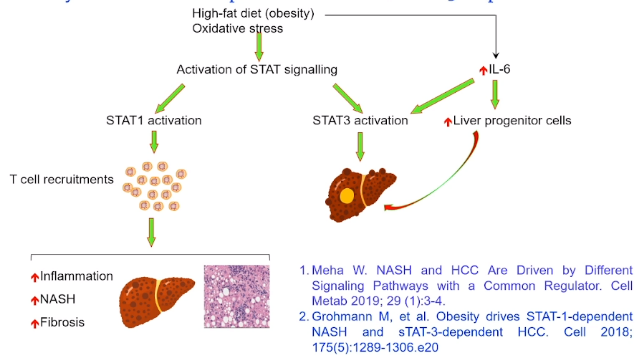
图6 肥胖发生脂肪性肝炎和肝癌的不同途径
(引自讲者幻灯)
除了肥胖外,糖尿病(主要是2型糖尿病)也可以增加原发性肝癌的发病风险。对于酒精滥用、慢性病毒性肝炎或是NAFLD,糖尿病都可能增加慢性肝病患者肝癌的发病风险2~3倍以上。此外,糖尿病也是肝癌患者术后复发的一个重要影响因素。日本一项统计数据结果显示,2型糖尿病患者死亡原因排在第一的是癌症(34.1%),其次是心血管疾病(26.8%)、感染(14.3%)、肝硬化(4.7%);而在2型糖尿病相关癌症死亡里肝癌排在第一位(8.6%),糖尿病患者肝癌+肝硬化的死亡率高达13.3%。
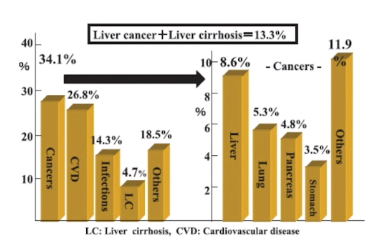
图7 糖尿病患者死亡原因(一项日本研究)
(引自讲者幻灯)
NAFLD与病毒性肝炎
事实上,丙肝病毒(HCV)感染本身就可以诱发胰岛素抵抗,增加肝脏脂肪变或2型糖尿病的发病风险。另外,在干扰素抗病毒时代,胰岛素抵抗、脂肪肝是病毒应答效果不好的影响因素,而通过有效改善胰岛素抵抗和降血糖治疗后,干扰素利巴韦林抗HCV的治疗效果提高。但对于HCV感染,患者发生胰岛素抵抗、肥胖、糖尿病、代谢综合征、脂肪肝后将导致疾病预后不佳;但通过有效干预HCV也可逆转胰岛素抵抗和代谢紊乱等。
NAFLD常与慢性乙型肝炎共存,尤其在亚洲人群中。尽管慢性乙肝病毒(HBV)感染与NAFLD患病率和发病率呈负相关,但慢性乙型肝炎患者脂肪肝患病率也在逐渐增加。欧洲和加拿大的一项研究纳入1089例慢性乙型肝炎患者,在长达13年的随访过程中,有17%的患者发生NASH,这部分患者的寿命缩短,肝癌发生风险和肝移植需求显著增多。所以一定要重视代谢功能障碍对慢性乙型肝炎患者肝硬化甚至肝癌的影响。
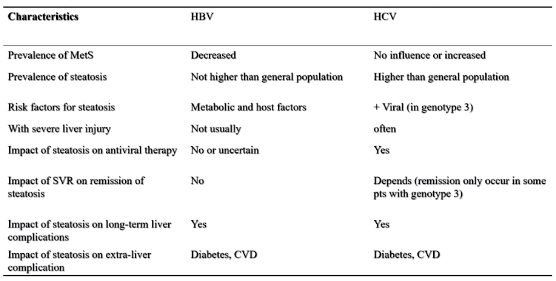
图8 乙肝和丙肝糖尿病患者特征比较
(引自讲者幻灯)
2020年国际专家小组提出将NAFLD更名为MAFLD。新的定义采用肯定性而非排他性诊断方法,将脂肪肝同时合并超重/肥胖、2型糖尿病、代谢功能障碍等任何一项条件定义为MAFLD。新的定义也明确指出,MAFLD可以发生在酒精滥用、慢性嗜肝病毒感染等其他肝病的个体。
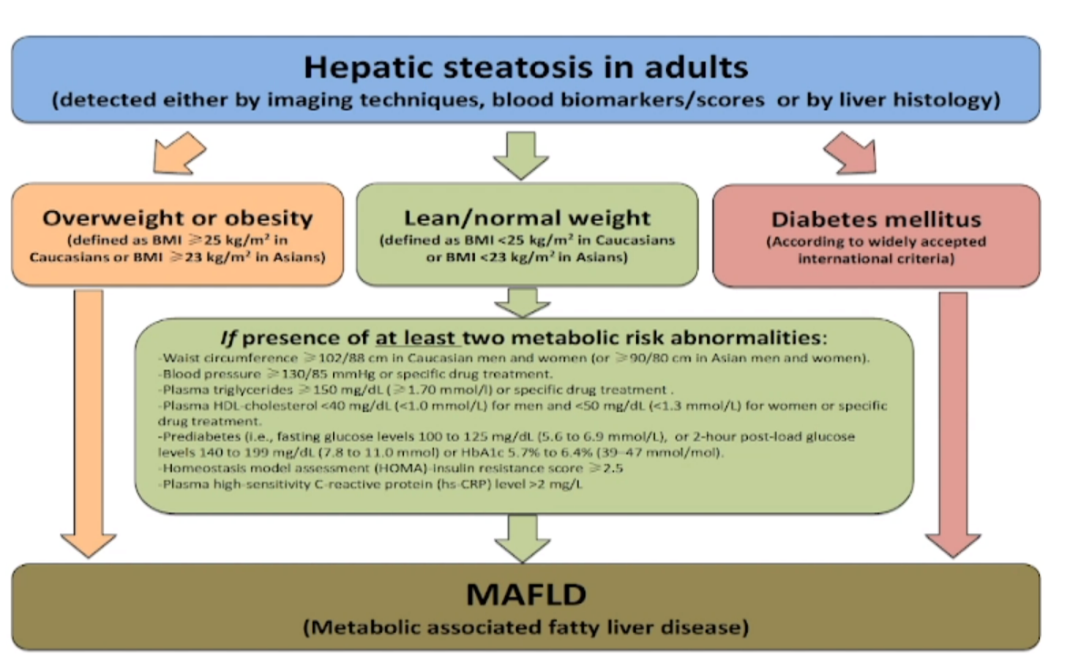
图9 MAFLD的诊断标准[11]
(引自讲者幻灯)
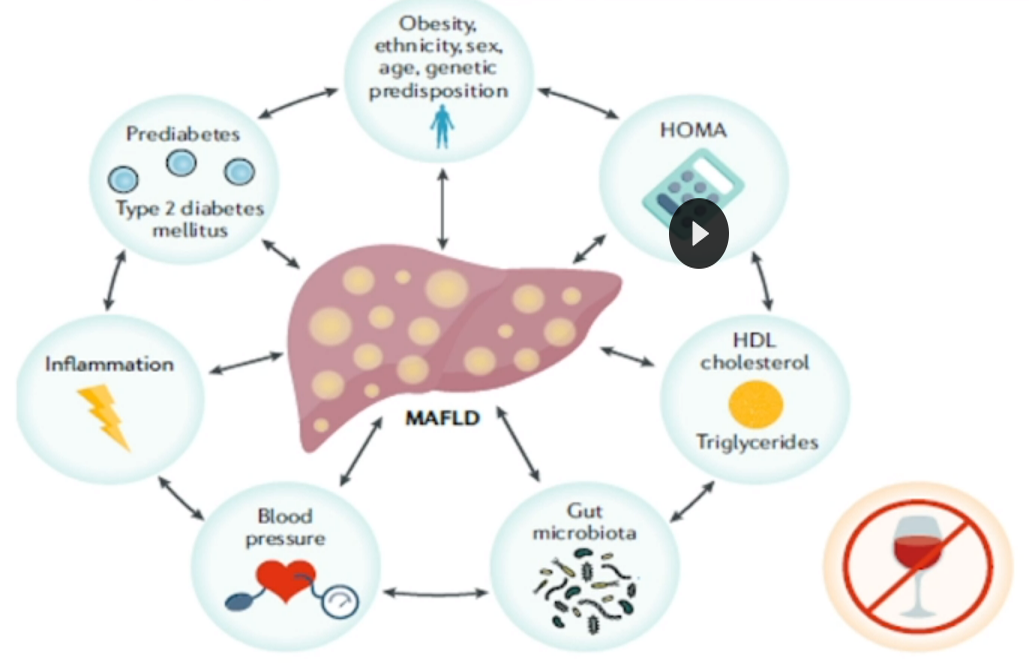
图10 MAFLD的相关疾病
(引自讲者幻灯)
小 结
代谢综合征是心血管代谢危险因素的聚集状态,包括内脏肥胖、高血压、高血糖、血脂紊乱、高尿酸血症、肌少症性肥胖等;动脉粥样硬化相关心血管疾病、恶性肿瘤和肝硬化并发症是其死亡的主要原因。代谢综合征相关疾病众多且危害严重,其中胰岛素抵抗和代谢性炎症是其“共同土壤”,并与NAFLD、2型糖尿病互为因果,共同促进动脉粥样硬化相关的心脑和外周血管疾病以及代谢性炎症相关的肝外恶性肿瘤的发生和发展。
参考文献:
1. Reaven GM.Banting Lecture 1988.Role of insulin resistance in human disease.Diabetes,1988,37:1595—1607
2. Dagnosis and classification of diabetes mellitus and its complications.Report of a WHO consultation.EHO/NCD/NCS,1999:31-32.
3. Expert panel on decefion,evaluation and treatment of high blood cholesterol in adults. Executive summary of the third report of the National Cholesteml Education Program(NCEP) expert panel on detection, evaluation and treatment of high blood cholesterol in adults(Adult treatment panel III).JAMA,2001,285:2486-2497.
4. International Diabetes Federation. The IDF consensus worldwide definition 0f the metabolic syndrome[EB/OL].
5. Lancet 2005; 366:1059. Obesity 2007;15:2817-2824. HBPT INT 2007.
6. Fan JG, Peng YD. Hepatobiliary Pancreat Dis Int. 2007;6(6):572-8. 7. Patrick L. Altern Med Rev, 2002, 7:276-291.
8. Fan JG, JGH, 2007, 22: 794-800.
9. Simon TG, et al. Hepatology, 2021; 74(5): 2410-2423.
10. Meha W. NASH and HCC are driven by different signaling pathways with a common regulator. Cell Metab 2019; 29(1):3-4.
11. Eslam M, et al. J Hepatol. 2020, 73:202-209.

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
访谈
专家访谈
脂肪肝
发表评论
全部评论
