当前位置:AASLD-美国肝病研究学会年会 » 正文
AASLD五分钟丨范建高教授:盘点脂肪肝领域获奖研究(下)
—— 作者: 时间:2022-11-11 03:48:33 阅读数:
54
编者按
为给广大肝病医生提供有关2022美国肝病研究学会(AASLD)年会更新鲜、更热点、更重磅的一手学术资料,《国际肝病》特设“AASLD五分钟”专题报道。在AASLD大会期间,我们将特别邀请国内肝病专家作为我们的特约播报员,针对病毒性肝炎、NAFLD/NASH、酒精肝、肝硬化、终末期肝病、自身免疫性肝病以及肝癌等不同肝病领域,从临床医生视角精选各领域最重磅的研究,并对以上研究内容进行精彩的解读与总结。本期我们特别邀请到上海交通大学医学院附属新华医院消化内科范建高教授为广大读者带来NAFLD/NASH领域的六项获奖研究。
研究四
NAFLD患者磁共振弹性成像自动读取结果的可靠性:一项国际前瞻性队列研究(大会摘要号:74)
研究背景
无创性评估NAFLD患者的肝纤维化严重程度是临床诊疗实践的重要需求。鉴于磁共振弹性成像(MRE)需要手动选择感兴趣的区域进行评估,目前已经开发成功一种自动的肝脏硬度估算算法,但其在NAFLD患者中的诊断性能还有待评估。本项研究评估了人工MRE与自动化检测的肝脏硬度值(LSM)之间的一致性,并确定两种方法在评估进展期肝纤维化方面的准确性。
研究方法
这是一项全球多中心的前瞻性临床研究,对操作者进行遮盲,纳入同期接受肝活检和MRE评估的NAFLD成人患者。所有的肝脏活检标本均由一名肝脏病理学专家使用NASH CRN组织学评分系统进行评估和评分,并对成像数据进行盲查。MRE检测LSM分别由当地的专家分析师手动进行或使用自动化方法(Hepatogram plus+)进行,并经专家分析师审查。用类内相关系数和Bland-Altman分析两两评估的重复性。通过受试者工作特征曲线(ROC)分析评估进展期肝纤维化(F3-4)的准确性。
研究结果
共有来自北美和亚洲4个医院的137例成年NAFLD患者(62%为女性)参与了此项研究。平均年龄为56(±12)岁,体重指数为31.6(±4.8)kg/m2。肝活检组织纤维化分期分布为F0期40例(29.2%)、F1期35例(25.5%)、F2期18例(13.1%)、F3期23例(16.8%)以及F4期21例(15.3%)。手工和自动化方法得到的LSM具有很强的相关性(r=0.97),并具有良好的可重复性(偏差0.09 kPa)。手工和自动化分析诊断进展期肝纤维化的AUROC分别为0.92 (95%CI:0.88-0.97)和0.93(95%CI:0.89-0.97),证明了与肝活检作为参考的良好交叉验证(见图1)。
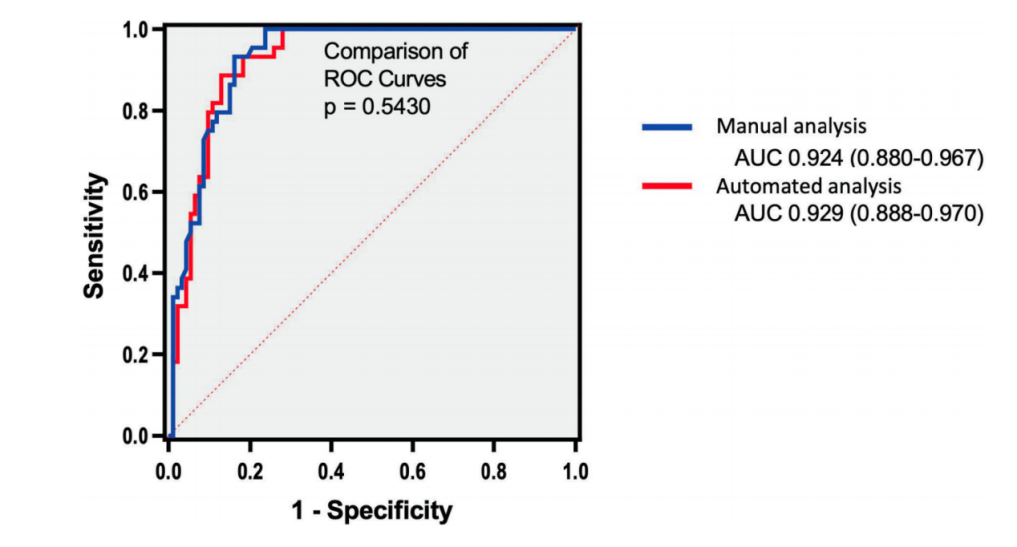
图1. 人工和自动化分析诊断NALFD患者进展期肝纤维化的AUROC
研究结论
该项研究结果证明了由MRE自动所测得的LSM与专家分析师测量的结果相一致,这种自动化方法具有极高的准确性。
专家点评
临床上,有无显著性肝纤维化是影响NASH患者预后的最重要的影响因素。目前在肝纤维化的无创性评估方法中,基于MRE所测得的LSM在判断肝纤维化严重程度方面其准确性高于瞬时弹性成像及其他肝纤维化诊断模型。该项研究表明,MRE经由人工和自动化方法获得的LSM具有很强的相关性,并且重复性很好。这意味着我们已经向肝纤维化的自动化评估方面迈进。它不仅可以节省时间,还可以进一步减少人为误差。总而言之,关于肝纤维化的无创性诊断的发展方向,除了包括发现新的生物学标志物以外,还包括基于MRE的人工智能自动化检测。
研究五
Cilofexor联合Firsocostat对NASH相关进展期肝纤维化有潜在疗效(大会摘要号:75)
研究背景
伴有进展期肝纤维化的非酒精性脂肪性肝炎(NASH)是脂肪肝患者肝脏相关死亡的主要原因。然而,目前还没有获批的NASH治疗药物。Cilofexor是一种新型特异性非类固醇性法尼醇X受体(FXR) 激动剂,前期的研究提示Cilofexor可以减少NASH小鼠肝纤维化程度、降低门脉压力。Firsocostat是乙酰辅酶A羧化酶抑制剂,也被用于NASH的防治研究。在一项IIb期临床试验中,Cilofexor和Firsocostat联合治疗可使NASH CRN肝纤维化评分显著降低,肝组织学肝纤维化分期从F3-F4期降为≤F2期。本项研究旨在通过新型生物标志物检测技术SomaScan?评估Cilofexor联合Firsocostat治疗下的NASH患者血浆蛋白组学标志物的变化。
研究方法
研究共纳入198例因NASH导致的桥接纤维化(F3)或代偿期肝硬化(F4)的NASH患者,将其随机分为安慰剂组、Cilofexor组、Firsocostat组以及两药联合组。根据NASH CRN对纤维化分期和NASH活动性评分(NAS)进行分级。通过SomaScan?对160例配对基线(BL)和第48周(W48)血浆样本的蛋白质组学结果进行分析。采用Jonckheere趋势检验和Logistic回归评估基线时血浆生物标志物与NAS和肝纤维化分期的相关性。采用线性混合效应模型评估各组血浆标志物从基线时到第48周的变化。
研究结果
在基线时,血浆中58个蛋白质水平与肝活检组织NAS评分显著相关(P<0.01);呈现丰富的肝细胞特异性蛋白的生物途径,与已发表的文献相似(PMID: 34600973);59个蛋白质的基线水平在肝硬化(F4)与非肝硬化(F2-F3)的NASH患者之间有显著差异(P<0.01,图2A)。
治疗48周时,肝硬化患者基线水平较高的蛋白质在联合治疗组显著减少,而基线水平较低的蛋白质则在联合治疗组显著增加(图2B),提示联合治疗逆转了进展期肝纤维化阶段的NASH患者的肝硬化表型。然而,Firsocostat或Cilofexor的单药治疗并没有明显逆转血浆中这些蛋白质的变化。
与安慰剂组相比,治疗48周时联合疗法使得更多的血浆蛋白质发生显著变化(与安慰剂组相比P<0.05)。进一步的分析显示,联合治疗组血浆中肝纤维化相关蛋白SPONDIN-1、LAMININ-2、IGFBP-7、C7、ADAMTSL2和TREM-2均显著减少(图2C)。蛋白质变化的通路分析显示,联合治疗组的生物通路发生了显著改变,包括与细胞外基质组装相关的通路减少。
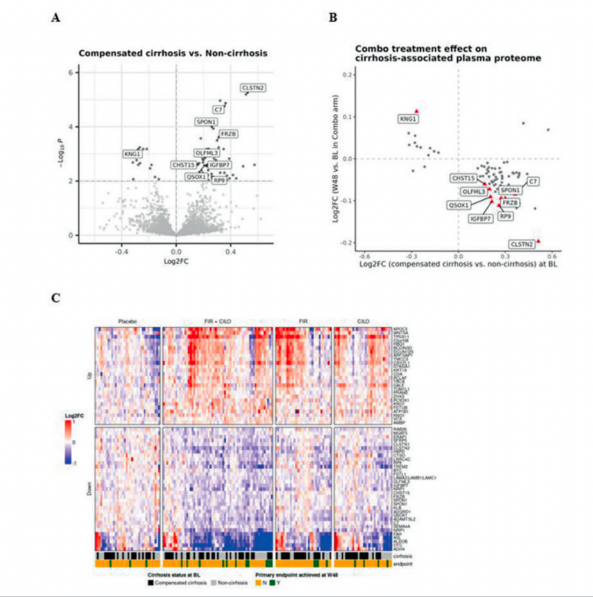
图2. A)基线时肝硬化与非肝硬化NASH患者之间蛋白质表达差异;B)48周时联合治疗组肝硬化患者蛋白质水平的显著变化;C)基线和第48周时各组血浆样本的蛋白质组学变化
研究结论
对进展期肝纤维化NASH患者的SomaScan?血浆蛋白质组学分析显示,与单药治疗相比,Cilofexor与Firsocostat联合治疗具有特异性药物活性。以蛋白质组变化为代表的通路分析表明Cilofexor与Firsocostat在改善肝纤维化方面有一致的活性,提示该组合对NASH合并进展期肝纤维化患者中具有较好的治疗效果。
专家点评
该项研究通过一种新型的生物标志物检测技术SomaScan?评估了Cilofexor+Firsocostat联合治疗在NASH患者中的发挥疗效的具体机制,即血浆蛋白组学水平的生物学标志物变化。它给我们的启示是,不仅要研究NASH肝纤维化发生发展的相关发病机制,更要去探索在临床治疗有效的NASH患者中,其肝纤维化逆转过程中的蛋白质组学变化。这不仅有助于我们无创评估和预测相关药物在NASH患者中的治疗效果,也为我们深入探讨NASH合并肝纤维化缓解的潜在作用机制提供了理论依据。毋庸置疑的是,随着NASH相关蛋白质组学研究的不断深入,一大批新型的生物学标志物将涌现出来,这有助于我们进一步加深对NASH发病机理的认识,推动NASH治疗的新药临床研究和疗效评估。
研究六
基于人工智能的CRN评分对于NASH患者肝组织学评估的探索性分析(大会摘要号:76)
研究背景
NASH患者的肝组织活检通常采用苏木精和伊红(H&E)以及马松三色(TC)染色基础上进行人工读片和评估,其结果具有一定的变异性。基于机器学习方法(ML)的评估相比人工评估可提高结果的可重复性。此项研究基于一种新的多段式ML模型,从H&E和TC染色标本中提取并结合互补的组织学信息,根据NASH临床研究网络病理学会(NASH-CRN)评估方案确定NAFLD的分级和分期。
研究方法
研究共纳入NASH临床试验中510例包含基线肝组织活检配对的H&E和TC染色标本,运用ML模型进行多染色图融合,以预测与NASH CRN组织学主要特征对应的顺序和连续CRN评分(图3)。比较每个特征的连续CRN评分,评估独立性、非侵入性和基于活检的肝病指标,以及RNAseq衍生的基因或通路的表达。

图3. NASH CRN评分的多染色图融合架构示意图
研究结果
研究结果表明,模型衍生的连续肝小叶炎症与肝细胞气球样变的评分高度相关(r=0.77),并且二者评分之间的相关性不大(r<0.5)。连续肝纤维化评分与FibroScan(r=0.51)、组织形态定量分析(r=0.72)等多个非侵入性肝纤维化指标相关,连续肝脂肪变性评分与肝脏脂肪含量相关(r=0.80)。
除此之外,连续CRN评分与一些特定基因的表达呈现出显著的相关性,例如:肝纤维化与CACNA1C,气球样变与FAT1、UBD和TXNRD1,炎症与UBD,肝脂肪变性与LPL和TREM2等存在密切相关。富集分析结果提示,Notch通路与肝纤维化之间存在正相关。
研究结论
既往研究表明,基于多段式ML的评分模型可以提高NASH中单染色方法的准确性。这项工作对此进行了拓展,证实了多段式模型衍生的组织学特征与非侵入性和基于肝活检的指标以及相关转录图谱,揭示了NASH潜在的生物学特性的不同方面。未来的工作将阐明通过多段式而非单段式方法捕获的组织学特征。
专家点评
这项研究的亮点在于:相较于传统的、单段式的ML评分模型,它建立了一种新型的、多段式的ML评分模型。除此之外,它还探讨了组织学特征与无创性生物学标志物之间的关联,最重要的是,它揭示了NASH潜在的一些生物学特性。因此,该项研究既是应用转化型研究,又是关于发病机制的探索性研究,值得我们临床医学和基础科学专家借鉴和参考。
参考文献:
1. Suzanne R. Sharpton, Kay Pepin, Ricki Bettencourt, et al. Reproducibility of Automated Versus Manual Read of Magnetic Resonance Elastography in NAFLD: an International, Prospective Cohort Study. AASLD 2022 Abstract 74
2. Kris V Kowdley, Anita Kohli, Kaiyi Zhu, et al. Combination Therapy With Cilofexor And Firsocostat Improves Plasma Fibrosis Biomarkers In Patients With Advanced Fibrosis Due To NonAlcoholic Steatohepatitis. AASLD 2022 Abstract 75
3. John Abel, Chaitanya Dwivedi, Shima Nofallah, et al. Exploratory Analyses of NASH Histology Using CRN Scores Derived from a Multi-Stain Machine Learning Method. AASLD 2022 Abstract 76
往期回顾

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
访谈
专家访谈
脂肪肝
发表评论
全部评论


