当前位置:中华医学会肝病学学术年会暨中华医学会肝病学分会青年委员会青年论坛 » 正文
肝病年会丨韩涛教授:肝衰竭诊治的进展与挑战
—— 作者: 时间:2023-01-09 09:50:36 阅读数:
56
编者按:肝衰竭是多种因素引起的严重肝脏损害,导致肝脏合成、解毒、代谢和生物转化功能严重障碍或失代偿,出现以黄疸、凝血功能障碍、急性肾损伤/肝肾综合征、肝性脑病、腹水等为主要表现的一组临床症候群。肝衰竭患者病死率高,其诊治一直是临床实践中的热点和难点,备受相关领域专家的重视,虽然近些年取得了很大的进展,但是仍然存在很多问题,有待进一步加强临床与基础研究。
2023年1月7日,在厦门举行的中华医学会肝病学分会成立30周年大会暨2022年中华医学会肝病学分会学术年会上,南开大学人民医院韩涛教授在“重肝与人工肝专题会议”中发表了题为“肝衰竭诊治的进展与挑战”的主题报告,分享了肝衰竭的临床诊断与治疗,肝衰竭与肝再生的机制进展,组织工程、类器官、生物型人工肝新探索以及挑战与展望等内容,《国际肝病》特此整理报道。
一、肝衰竭的临床诊断与治疗
肝衰竭的分类及其定义一直是国内外有争议的问题,近些年来随着东西方学术交流的加强以及新的循证医学证据的增加,共识逐渐增多,但仍有不少分歧,有关指南及共识也在不断颁布。2022年美国胃肠病学会发布《慢加急性肝衰竭临床指南》,综合目前亚太肝病学会、欧洲肝病学会慢性肝衰竭联盟和北美终末期肝病研究联盟的标准,提出了具有一定包容性的慢加急性肝衰竭(ACLF)定义:
1
慢加急性肝衰竭是发生在伴或不伴肝硬化的慢性肝病基础上的一种具有潜在可逆性的疾病,在缺乏基础肝病治疗、肝脏支持系统治疗或肝移植的情况下,可能导致多器官衰竭和3个月内病死;
2
慢加急性肝衰竭通过慢性肝病、胆红素升高和INR延长来识别,肾脏、呼吸、循环或脑功能衰竭支持诊断的建立;
3
脏器衰竭的严重程度可以采用EASL-CLIF或 NACSELD脏器衰竭评分来评估。
依据我国《肝衰竭诊治指南(2018年版)》,肝衰竭可分为急性肝衰竭、亚急性肝衰竭、慢加急性(亚急性)肝衰竭和慢性肝衰竭。依据不同慢性肝病疾病基础,慢加急性肝衰竭可大致分为3型,①A型:慢性非肝硬化肝病基础上发生的ACLF;②B型:代偿期肝硬化基础上发生的ACLF,通常在4周内发生;③C型:失代偿期肝硬化基础上发生的ACLF。
细菌感染与侵袭性真菌感染是导致重症肝病死亡的重要因素,我国学者基于临床实践需求、结合循证医学证据制定了《终末期肝病合并感染防治专家共识(2021年更新版)》及《重症肝病合并侵袭性真菌感染诊治专家共识(2022年)》。积极防治并发症及其诱发因素对于改善患者的预后具有十分重要的意义。
非生物型人工肝在肝衰竭救治的重要作用越来越受到认可。我国学者制定了《人工肝血液净化技术临床应用专家共识(中英文版)》,国外急诊/重症相关专家小组撰写了《2022国际专家共识:肝衰竭患者的人工肝支持》(Artificial liver support in patients with liver failure: a modifed DELPHI consensus of international experts. 2022),主要针对肝衰竭患者的人工肝支持提供专家指导建议。中华医学会医学工程学分会干细胞工程专业学组制定了《干细胞移植规范化治疗肝硬化失代偿的专家共识(2021)》,对今后的干细胞移植治疗失代偿期肝硬化的临床工作提供参考和指导。
二、全程MDT管理:预警-内科-人工肝/脏器支持ICU-肝移植
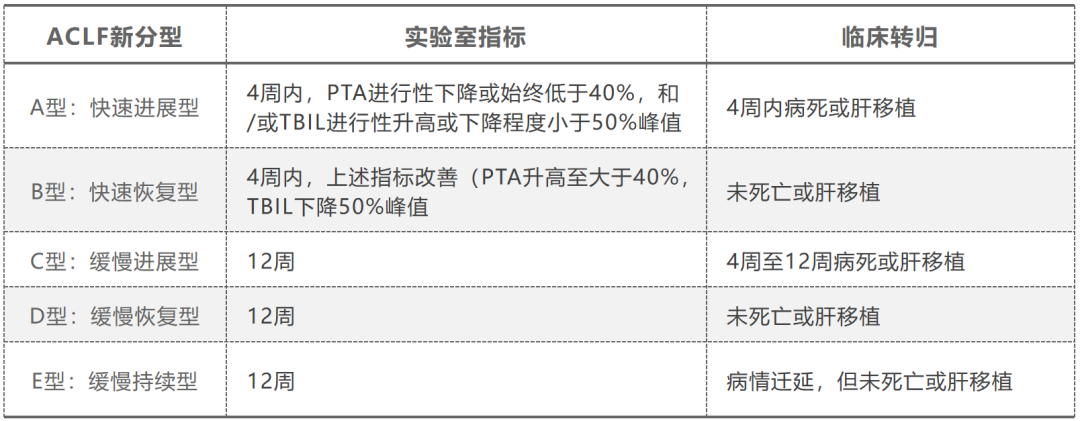
“三早一体系”的全程管理模式是目前肝衰竭治疗的基本策略。“三早”即早期预警、早期诊断、早期治疗;“一体系”即预警-内科-人工肝/脏器支持ICU-肝移植一体化的救治体系。预警、动态演变与预后判断、分层决策密切相关,近年来我国不少学者利用国内多中心研究做了大量工作。患者基线特征与动态变化是临床决策的重要基础,如一项研究提出构建新型动态评分模型,结合基线特征和临床指标的动态变化来预测ACLF的不同进展类型(图1)。陈煜等教授提出了ACLF新的分型,将临床常见的实验室指标与临床转归紧密结合(表1)。
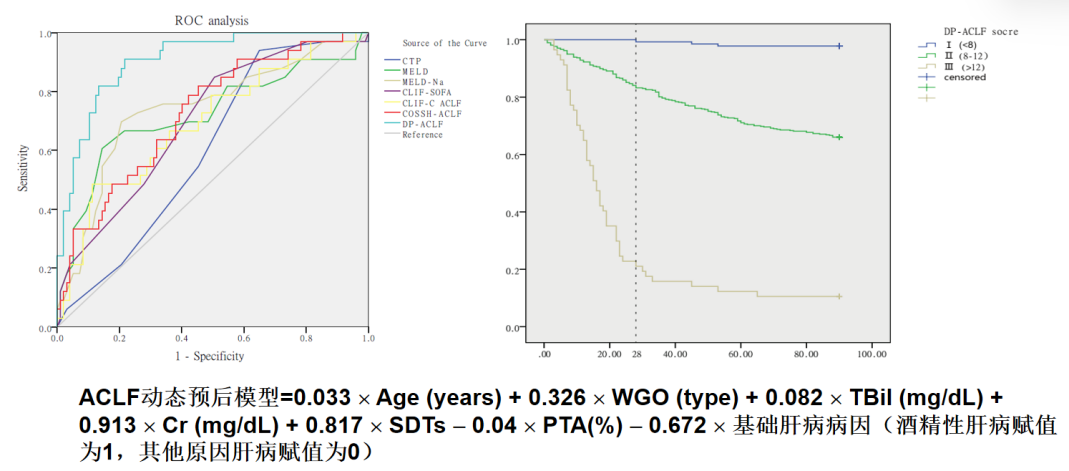
图1. ACLF动态预后模型
表1. ACLF新分型和临床转归
移植时机方面,目前供肝资源通常依据MELD或MELD-Na评分分配,但有不少学者认为MELD和MELD-Na评分可能低估ACLF的严重程度。ACLF肝移植可能需要考虑基于衰竭器官的类别与数目的优先器官资源分配策略。ACLF患者是否应在供者资源分配具有优先权,这一问题仍有争论。
移植治疗时间窗方面,2020年中国医师协会器官移植分会发布的《成人慢加急性肝衰竭肝移植围手术期管理专家共识》中指出,诊断ACLF后3~7天CLIF-C ACLF 2~3级患者需要优先进行肝移植治疗。AARC评分中,ACLF I-II级治疗1周内评分无下降患者和AARC ACLF III级患者应优先行肝移植治疗。考虑到慢加急性肝衰竭的复杂性,黄金时间窗具体是多长时间合适,临床上仍需要做好动态评估与分层决策。肝移植手术禁忌证包括:①不可逆性脑功能损伤、弥漫性脑水肿导致昏迷、脑干受累;②未控制的严重肺部感染,平均肺动脉压力(mPAP)>50 mmHg;③ACLF-3级需要用大剂量升压药物但仍无法维持正常血压。上述禁忌证也提示除了关注脏器衰竭的数量外,还要关注脏器衰竭的类型及相关并发症。
此外,基于慢加急性肝衰竭发病机制探索新的治疗方案是十分重要的。如针对全身炎症反应、免疫代谢障碍、肝再生等多个环节的研究与进展也值得关注。粒细胞集落刺激因子(G-CSF)是否能够改善慢加急性肝衰竭的生存率尚存在争议,有学者认为是否有效可能与治疗人群与时机的选择有关,G-CSF治疗可能需要个体化。
三、肝衰竭与肝再生机制的新探索
肝衰竭主要涉及肝细胞大量死亡与再生能力不足、全身炎症反应与免疫代谢功能障碍等多个方面。全身炎症反应可引起免疫介导的组织损伤和代谢异常、凝血异常等。在肝衰竭机制方面,近年来有不少新探索。
2022年Zhang IW等发现,ACLF患者白细胞存在严重的线粒体损伤和功能障碍,从而影响其免疫代谢功能。2021年Zaccherini G等发现,ACLF氨基酸等代谢组学特征和严重的全身炎症反应及氧化应激密切相关;亚精胺水平的降低,提示与肝细胞再生密切相关的自噬受到抑制。2021年Trovato FM等发现,ACLF溶血磷脂酰胆碱(LPCs)、自分泌运动因子、溶血磷脂酸(LPA)轴的失衡与全身炎症反应及病死率相关。2022年Von Meijenfeldt FA等发现血浆特定中性粒细胞胞外陷阱(NETs)标记物水平升高与ALF患者预后不良相关,可导致疾病进展。
2022年Lin等发现卵泡抑素(follistatin,FST)可通过调控肝祖细胞(liver progenitor cells, LPCs)中激活素-肝细胞核因子HNF 4α-凝血因子轴,从而影响伴有肝细胞大面积坏死的肝衰竭患者的临床结局。FST受胰高糖素和胰岛素调控,提示代谢在肝衰竭的发病机制中发挥重要作用。2022年Li B等利用宏基因组测序技术(mNGS)对肝硬化急性失代偿患者中循环微生物的基因组片段进行评估,发现肝硬化急性失代偿(AD)尤其是ACLF患者,具有明显的非嗜肝病毒(NHVs)特征;人巨细胞病毒是AD患者最常见的NHVs感染源,与AD患者进展为ACLF及90天病死率密切相关。
肝脏再生过程十分复杂,涉及肝再生启动、持续与终止等多个环节,其中肝再生的细胞来源、细胞的可塑性、肝再生过程中血管与胆管重建等系列热点问题,随着新的技术手段的应用,不断丰富和更新了既往对肝再生的认知,为肝脏损伤修复乃至肝衰竭的救治提供新的思路。2021年He L等在肝部分切除、胆管结扎和CCL4等不同肝损伤模型中,观察到新生肝细胞起源区域存在差异。2022年Wen Y等发现白介素33(IL-33)具有通过IL-33/ST2/5-羟色胺通路促进部分肝切除小鼠肝再生的作用。2022年Fan S等发现过氧化物酶体增殖物激活受体α(PPAR α)可以通过激活YAP-TEAD调控肝脏再生及肝脏体积。
四、组织工程、类器官、生物型人工肝的探索
有关新型组织工程肝脏、类器官和生物型人工肝领域也有新的探索,我国不少学者在此领域也做出非常出色的工作,亟需进一步推动相关临床转化。
2022年Higashi H等将猪肝来源的去细胞支架上制备的生物工程肝脏,移植给肝功能衰竭的猪,观察到移植28天,肝功能得到改善,肝脏特异性基因表达上调,这为未来制备人类可移植肝提供一定的实验基础。2022年Liu C等通过在体内将成纤维细胞直接重编程为肝细胞,将脾脏转化为类肝样器官,发挥基本的肝脏功能,提示有可能成为治疗终末期肝病的潜在手段。
类器官领域的研究值得关注,2021年Yang H等利用HepaRG细胞和生物墨水构建了三维生物打印的肝脏类器官(3DP-HOs),体外分化7 d后具有合成白蛋白、药物代谢和糖原储存等多种肝脏功能;将其移植到Fah、Rag2基因敲除肝损伤小鼠,小鼠获得人类特有的药物代谢活性,肝脏特异性蛋白合成增加,且移植的3DP-HOs还形成了功能性血管系统,小鼠的存活率显著提高。
五、挑战与展望
ACLF 的定义与短期高病死率关联,近年来随着早期预警干预理念及治疗水平的提升对病死率有很大影响,这是临床定义时值得思考与研究的问题。未来还需要通过规范的多中心临床研究证据,进一步缩小不同ACLF定义之间的差异,定义需要更加明晰,既要有普适性,又要做好精准分层。不同类型的肝衰竭均需要关注,肝衰竭“三早一体系”的全程管理仍是目前的基本策略。未来需进一步阐明包括人工肝、细胞治疗、肝移植的最佳治疗时机,并探索新的发病机制-生物标志物-治疗靶点,寻找新的治疗突破。
参考文献:
1. Bajaj JS, O'Leary JG, Lai JC, et al. Acute-on-chronic liver failure clinical guidelines.Am J Gastroenterol,2022,117(2):225-252.
2. 中华医学会感染病学分会肝衰竭与人工肝学组,中华医学会肝病学分会重型肝病与人工肝学组.肝衰竭诊治指南( 2018年版).中华肝脏病杂志,2019,27(1):18-26.
3. 中华医学会感染病学分会.终末期肝病合并感染诊治专家共识(2021年版). 中华肝脏病杂志,2022,30(2):147-158.
4. 中国研究型医院学会肝病专业委员会重症肝病学组,中华医学会肝病学分会重型肝病与人工肝学组.重症肝病合并侵袭性真菌感染诊治专家共识.中华肝脏病杂志,2022,30(2):159-168.
5. 中华医学会肝病学分会重型肝病与人工肝学组.人工肝血液净化技术临床应用专家共识(2022年版).临床肝胆病杂志,2022,38(4):767-775.
6. Chen Y, Han T, Duan Z; Severe Liver Disease and Artificial Liver Group,Chinese Society of Hepatology, Chinese Medical Association. Clinical application of artificial liver and blood purification: expert consensus recommendations.Hepatol Int. 2022 Nov 2. doi: 10.1007/s12072-022-10430-8.
7. Saliba F,Ba?ares R, FS, Wilmer A,et al.Artificial liver support in patients with liver failure:a modified DELPHI consensus of international experts.Intensive Care Med,2022,48,1352-1367.
8. 中华医学会器官移植学分会围手术期管理学组.肝衰竭肝移植围手术期管理中国专家共识 2021.中华消化外科杂志, 2021,20(8) : 835-840. DOI: 10.3760/cma.j.cn115610-20210626-00312
9. Yu Z, Zhang Y, Cao Y, Xu M, You S, Chen Y, Zhu B, Kong M, Song F, Xin S, Duan Z, Han T. A dynamic prediction model for prognosis of acute-on-chronic liver failure based on the trend of clinical indicators. Sci Rep. 2021 ;11(1):1810.
10. 徐曼曼,孔明,曹影影,刘芳,韩涛,段钟平,陈煜.慢加急性肝衰竭分型新视点:基于临床转归的动态分型新标准.中华肝脏病杂志 2020,28(4):319-325.
11. 中国医师协会器官移植医师分会移植免疫学专业委员会.成人慢加急性肝衰竭肝移植围手术期管理专家共识2021. 器官移植, 2020, 11(5): 533-542.
12. Engelmann C, Herber A, Franke A, Bruns T, Reuken P, Schiefke I, Zipprich A,Zeuzem S, Goeser T, Canbay A, Berg C, Trebicka J, Uschner FE, Chang J, Mueller T, Aehling N, Schmelzle M, Splith K, Lammert F, LangeCM, Sarrazin C, Trautwein C, Manns M, H?ussinger D, Pfeiffenberger J, Galle PR, Schmiedeknecht A, Berg T.Granulocyte-colony stimulating factor (G-CSF) to treat acute-on-chronic liver failure: A multicenter randomized trial (GRAFT study). J Hepatol. 2021;75(6):1346-1354.
13. Wong F. Clinical Consequences of Infection in Cirrhosis: Organ Failures and Acute-on-Chronic Liver Failure. Clin Liver Dis (Hoboken). 2019 ;14(3):92-97.
14. Zhang IW, Curto A, López-Vicario C, Casulleras M, Duran-Güell M, Flores-Costa R, Colsch B, Aguilar F, Aransay AM, Lozano JJ, Hernández-Tejero M, Toapanta D,Fernández J, Arroyo V, Clària J. Mitochondrial dysfunction governs immunometabolism in leukocytes of patients with acute-on-chronic liver failure. J Hepatol. 2022;76(1):93-106.
15. Zaccherini G, Aguilar F, Caraceni P, Clària J, Lozano JJ, Fenaille F,Castelli F, Junot C, Curto A, Formentin C, Weiss E, Bernardi M, Jalan R, Angeli P, Moreau R, Arroyo V. Assessing the role of amino acids in systemic inflammation and organ failure in patients with ACLF. J Hepatol. 2021 ;74(5):1117-1131.
16. Trovato FM, Zia R, Napoli S, Wolfer K, Huang X, Morgan PE, Husbyn H, Elgosbi M, Lucangeli M, Miquel R, Wilson I, Heaton ND, Heneghan MA, Auzinger G,Antoniades CG, Wendon JA, Patel VC, Coen M, Triantafyllou E, McPhail MJ.Dysregulation of the Lysophosphatidylcholine/Autotaxin/Lysophosphatidic Acid Axis in Acute-on-Chronic Liver Failure Is Associated With Mortality and Systemic Inflammation by Lysophosphatidic Acid-Dependent Monocyte Activation. Hepatology.2021 ;74(2):907-925.
17. Von Meijenfeldt FA,Stravitz RT,et al. Generation of neutrophil extracellular traps in patients with acute liver failure is associated with poor outcome. Hepatol,2022,75(3):623-633.
18. Lin T, Wang S, Munker S, et al. Follistatincontrolled activinHNF4αcoagulation factor axis in liver progenitor cells determines outcome of acute liver failure. Hepatol, 2022, 75.
19. Li B, Hong C, Fan Z, et al.Prognostic and therapeutic significance of microbial cell-free DNA in plasma of people with acutely decompensated cirrhosis. J Hepatol,2022,117(2):225-252.
20. He L, et al.Proliferation tracing reveals regional hepatocyte generation in liver homeostasis and repair.Science,2021,26;371(6532):eabc4346.
21. Wen Y, Emontzpohl C, Xu L, et al. Interleukin-33 facilitates liver regeneration through serotonin-involved gut-liver axis. Hepatology, 2022; 00: 1– 13.
22. Fan S, Gao Y, Qu A, et al. YAP-TEAD mediates PPARα–induced hepatomegaly and liver regeneration in mice. Hepatol, 2022, 75(1): 74-88.
23. Higashi H, Yagi H, Kuroda K, et al. Transplantation of bioegineered liver capable of extended function in a preclinical liver failure model. Am J Transplant, 2022, 22(3), 731-744.
24. Liu C, Wang L, Xu M, et al. Reprogramming the spleen into a functioning ‘liver’in vivo. Gut, 2022. DOI: 10.1136/gutjnl-2021-325018.
25. Yang H, Sun L, Pang Y, Hu D, Xu H, Mao S, Peng W, Wang Y, Xu Y, Zheng YC, Du S, Zhao H, Chi T, Lu X, Sang X, Zhong S, Wang X, Zhang H, Huang P, Sun W, Mao Y.Three-dimensional bioprinted hepatorganoids prolong survival of mice with liver failure. Gut. 2021 ;70(3):567-574.


声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
述评/点评
专家访谈
其他肝病
发表评论
全部评论