当前位置:中华医学会肝病学学术年会暨中华医学会肝病学分会青年委员会青年论坛 » 正文
徐京杭教授:MAFLD生活方式干预治疗进展
—— 作者: 时间:2023-02-05 05:53:19 阅读数:
91
代谢相关脂肪性肝病(MAFLD),曾用名非酒精性脂肪性肝病(NAFLD),全球患病率高达25%,严重危害人类健康并对社会造成巨大经济负担。久坐少动等不健康生活习惯、膳食热量过高、膳食结构不合理等不健康饮食习惯与MAFLD发病率不断增高密切相关。因此,改变不良生活方式是基石治疗。中华医学会肝病学分会成立30周年大会暨2022年中华医学会肝病学分会学术年会期间,北京大学第一医院徐京杭教授分享了MAFLD生活方式干预治疗进展。《国际肝病》特此报道,以飨读者。
一、NAFLD的疾病负担和危害
NAFLD是全球最常见的慢性肝病,其中10%~30%为非酒精性脂肪性肝炎(NASH)。全球肝硬化和慢性肝病负担重,2017年全球疾病负担调查(2017GBD)显示,2017年NASH导致慢性肝病患者数高达8.9亿,新发病例36.7万,而且疾病负担在不断上升中:2007年~2017年的10年间,残障年(一种疾病负担指标)的年龄标准化率改变达到10.4%;其中NASH占首位,年龄标准化率改变为23.5%。
NAFLD是一种与胰岛素抵抗(IR)和遗传易感密切相关的代谢应激性肝损伤,疾病谱包括非酒精性单纯性肝脂肪变、NASH、肝硬化和肝细胞癌(HCC)。患者起病隐匿且肝病进展缓慢,NASH患者肝纤维化平均7~10年进展一个等级,间隔纤维化和肝硬化是NAFLD患者肝病不良结局的独立预测因素。NAFLD相关肝硬化是指有肥胖症、代谢综合征、T2DM和(或)NAFLD病史的隐源性肝硬化。
2020年MAFLD新定义的国际专家共识建议将MAFLD作为更合适的疾病命名用于描述与代谢功能障碍相关的肝脏疾病,并将MAFLD相关肝硬化诊断标准设定为:没有典型脂肪性肝炎病理特征的肝硬化患者,既往病理符合MAFLD或既往影像提示肝脏脂肪变。
二、MAFLD的生活方式干预治疗进展
治疗方面,鉴于NAFLD是肥胖和代谢综合征累及肝脏的表现,大多数患者肝组织学改变处于单纯性脂肪肝阶段,治疗NAFLD的首要目标为减肥和改善胰岛素抵抗。非酒精性脂肪性肝病防治指南(2018年更新版)中首推生活方式干预,提倡给NAFLD患者提供包括健康饮食、加强锻炼和修正不良行为的生活方式干预的指导(图1)。其余治疗方式包括针对代谢综合征的药物治疗、减重手术、针对肝损伤的药物治疗和肝移植。有多项研究证实生活方式干预和减重对于MAFLD的基石治疗作用。

图1. 非酒精性脂肪性肝病防治指南(2018年更新版)对生活方式干预的推荐意见
(引自报告幻灯)
生活方式干预改善肝组织病理。2010年美国一项单中心随机对照试验(RCT)考察生活方式干预(饮食、运动、行为)对NAFLD的影响,主要结果指标是干预48周后NAFLD组织学活动度评分(NAS)的变化。31例经活检证实患有NASH的超重或肥胖受试者(BMI 25~40 kg/m2)以2:1的比例随机接受强化生活方式干预或对照组。研究设计和患者基线特征见图2。结果表明,48周后干预组降低体重、BMI、腰围、ALT、AST,减少肝组织脂肪、改善NAS,且减重越多者,NAS改善越明显(图3、图4)。
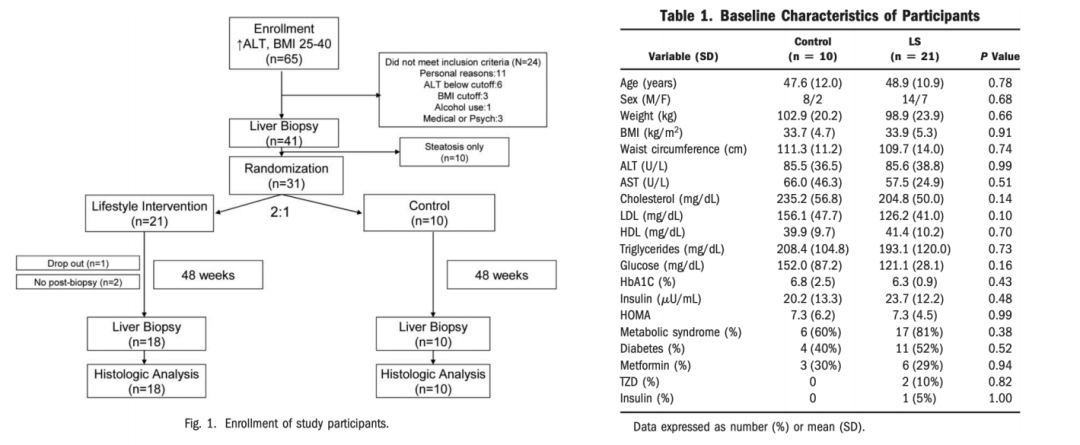
图2. 研究设计(左)和患者基线特征(右)
(引自报告幻灯)
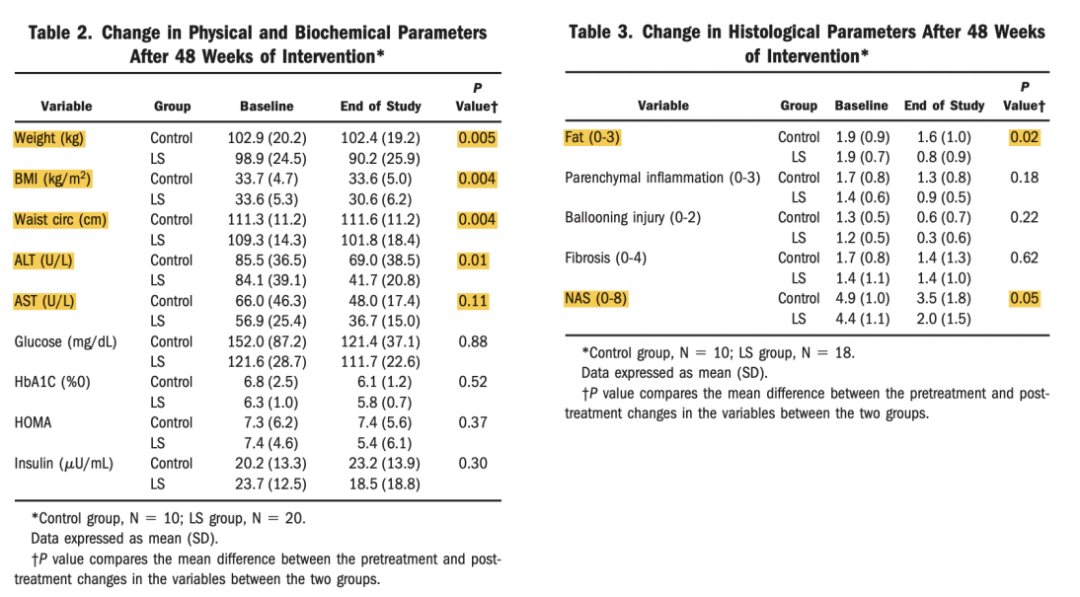
图3. 48周后生理、生物学、组织学参数自基线的改变
(引自报告幻灯)
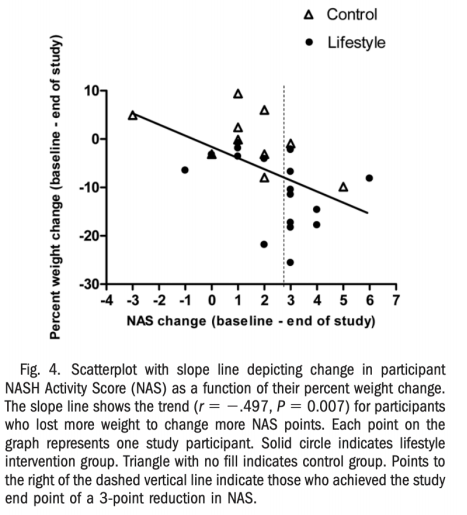
图4. NAS自基线的改变
(引自报告幻灯)
减重改善NASH。2012年一项纳入78项随机试验(NASH 38项,NAFLD 40项)的荟萃分析显示,减重≥7%可改善NAS(图5)。
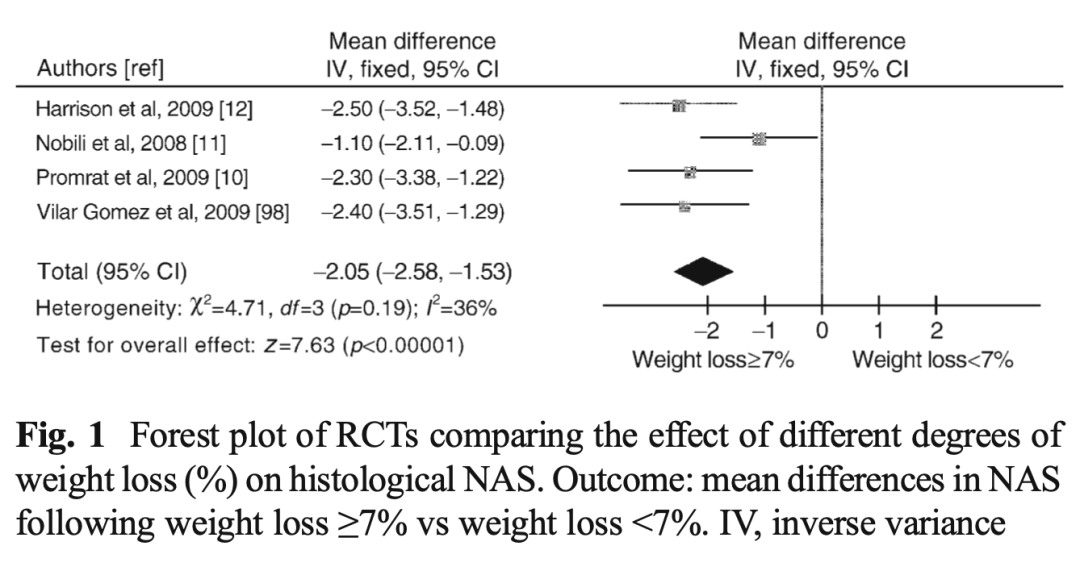
图5. 比较不同程度的减重对NAS改善的RCT的森林图
(引自报告幻灯)
运动减少肝脏脂肪。作为生活方式干预的一部分,运动对于改善NAFLD也有单独获益。2012年一项纳入12项研究的荟萃分析显示,有氧运动和(或)渐进性抗阻训练(不同时进行饮食干预)可减少肝内脂肪量(ES=-0.37,95% CI:-0.69~-0.06;P=0.020,图6)。
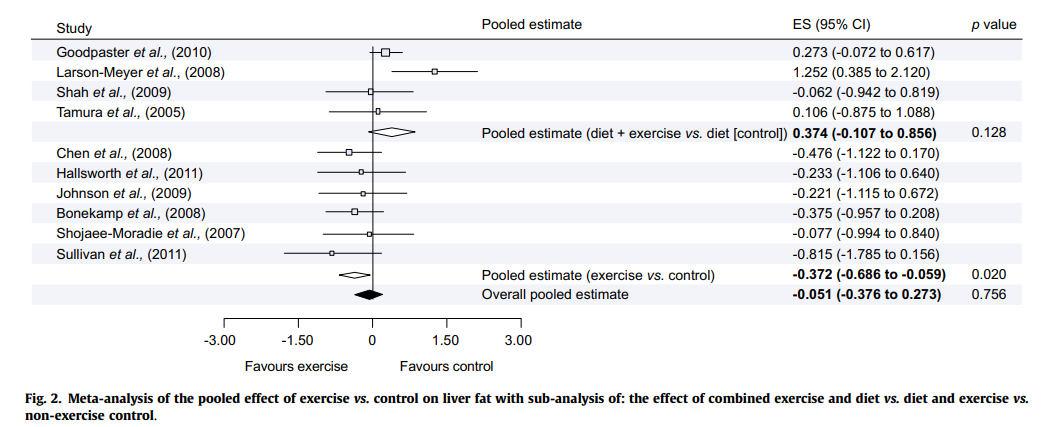
图6. 运动(不合并饮食干预)对减少肝脏脂肪的效果
(引自报告幻灯)
减重改善NASH组织学。2015年一项古巴单中心前瞻性研究,考察通过改变生活方式减轻体重的幅度与NASH组织学特征变化间的关系,入组293例经组织学确诊NASH的患者(平均年龄48.5岁,男性41%),基线平均BMI 31 kg/m2,ALT 52.4 U/L,AST 35.2 U/L,GGT 51.3 U/L,NAS≥5者比例为60%。其中261例完成基线和52周2次肝活检。生活方式改变包括低脂低卡饮食(碳水64%、脂肪22%、蛋白14%)和每周走路200分钟。研究结束时不同程度的减重与组织学结果改善的情况见表1。体重下降是NASH缓解、NAS改善、NAS≤2、纤维化改善、汇管区炎症等各个组织学终点的独立影响因素(表2)
表1. 不同减重程度的组织学改善情况
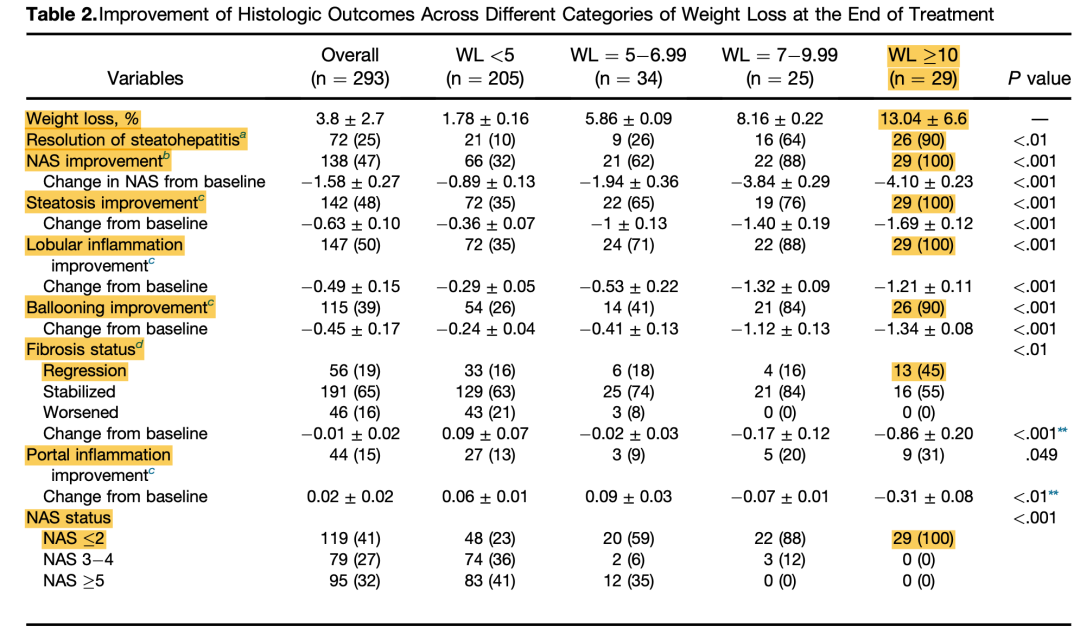
(引自报告幻灯)
表2. 治疗结束时减重与组织学终点改善间的关系
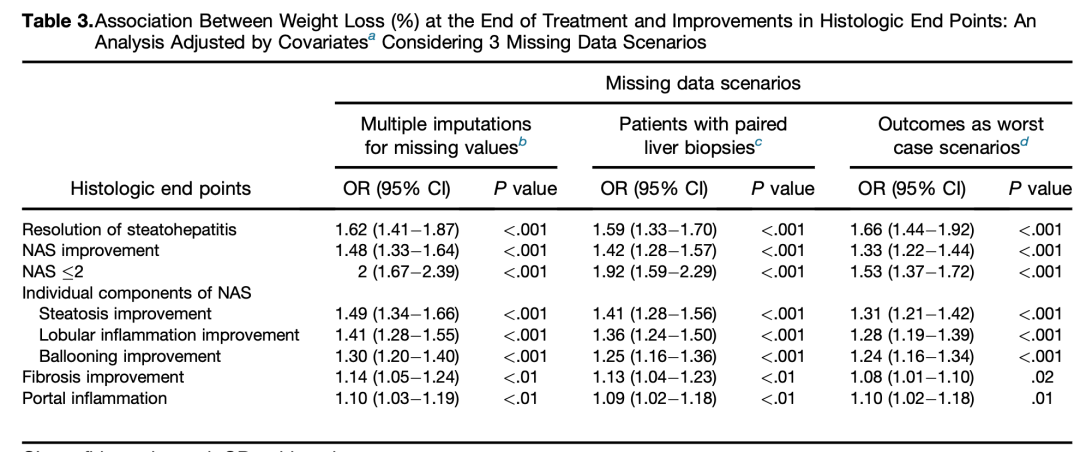
(引自报告幻灯)
地中海饮食或生活方式和减重可改善NAFLD患者的肝脏结果。2018年一项随机对照单盲临床试验中,纳入63例超重或肥胖患者(平均年龄50岁,基线BMI 31 kg/m2,男性68%)按1:1:1随机分入对照组(CG)、地中海饮食组(MDG)或地中海生活方式(MLG)组。88.8%的受试者完成为期6个月的研究。干预结束时,MDG或MLG组受试者比对照组体重下降幅度更大,对地中海饮食的依从性更高;此外,与其他两组相比,MLG组增加了剧烈运动(P<0.001),与对照组相比,增加了午休或午睡(P=0.04)(表3)。与对照组相比,在校正体重减轻和基线值后,MLG组的ALT水平<40 U/L(P=0.03)、ALT下降50%(P=0.009)和肝脏硬度(P=0.004)均有显著改善(表4)。
表3. 干预对生活方式特征的影响
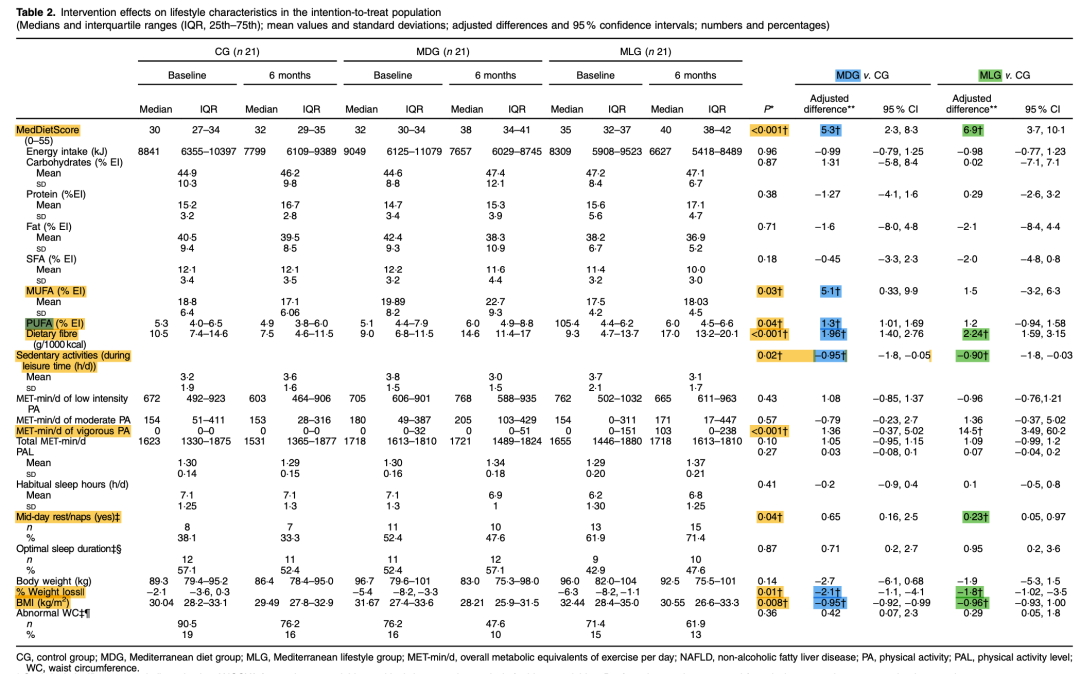
(引自报告幻灯)
表4. 干预对肝脏结果的影响
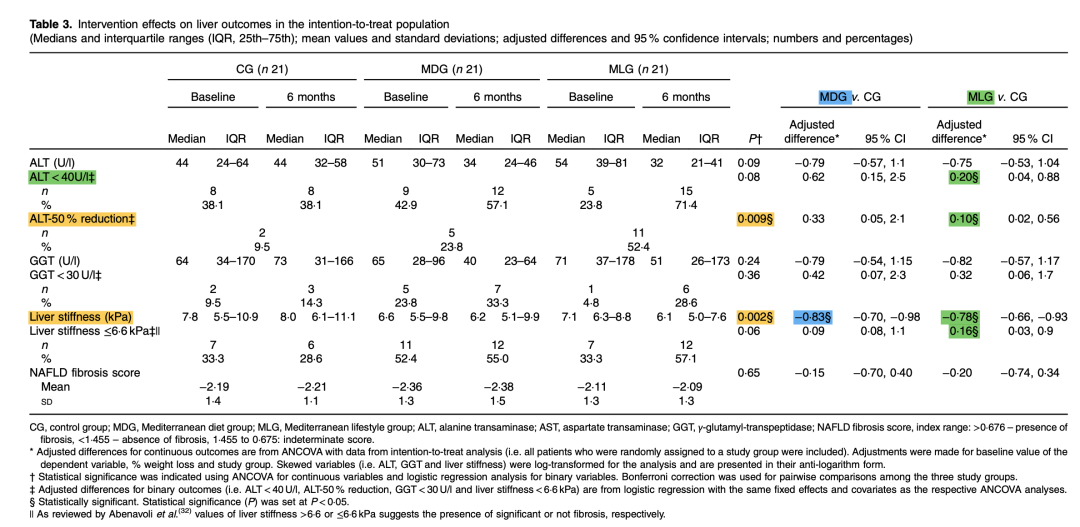
(引自报告幻灯)
体力活动与低病死率相关。2021年一项研究对2003~2006年间美国成人健康和营养检查调查数据进行纵向分析,共纳入2793例NAFLD患者(平均年龄48.9岁,基线BMI 32.6 kg/m2,高血压39.3%,糖尿病12.5%),平均随访10.6年。分析发现,较长的总体力运动(PA)与较低的全因病死率相关(表5)。较长的中等至剧烈运动(MVPA)与NAFLD较低的心血管病死率相关(但不包括癌症相关病死率)(表6、表7)。
表5. 基于体力活动状态的全因死亡率多因素HR
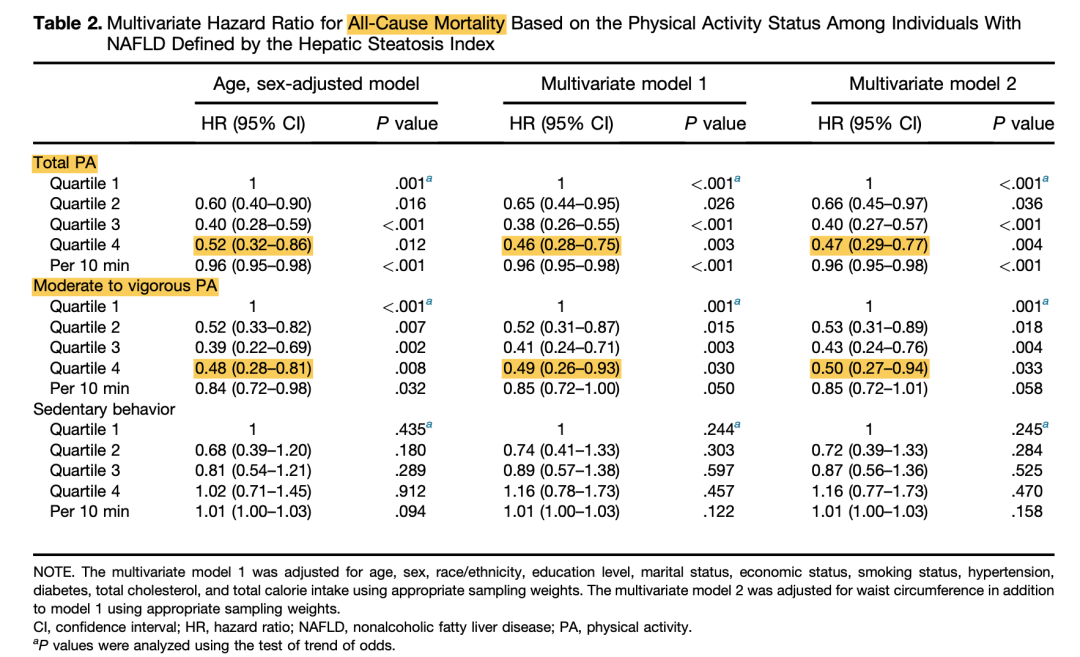
(引自报告幻灯)
表6. 基于体力活动状态的心血管病死率多因素HR
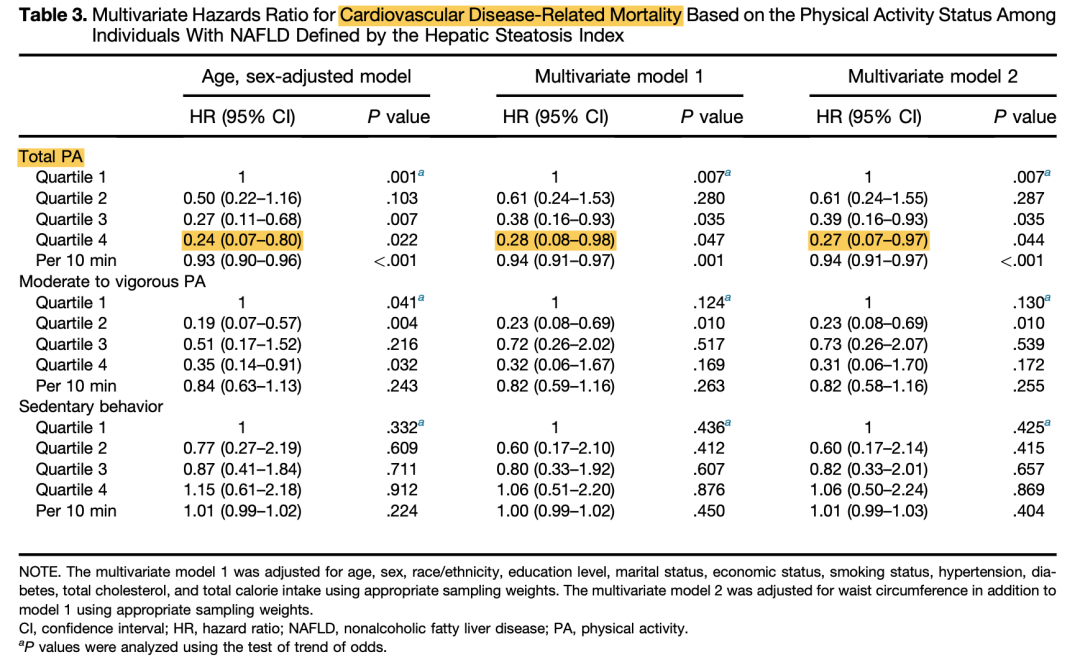
(引自报告幻灯)
表7. 基于体力活动状态的癌症相病死率多因素HR
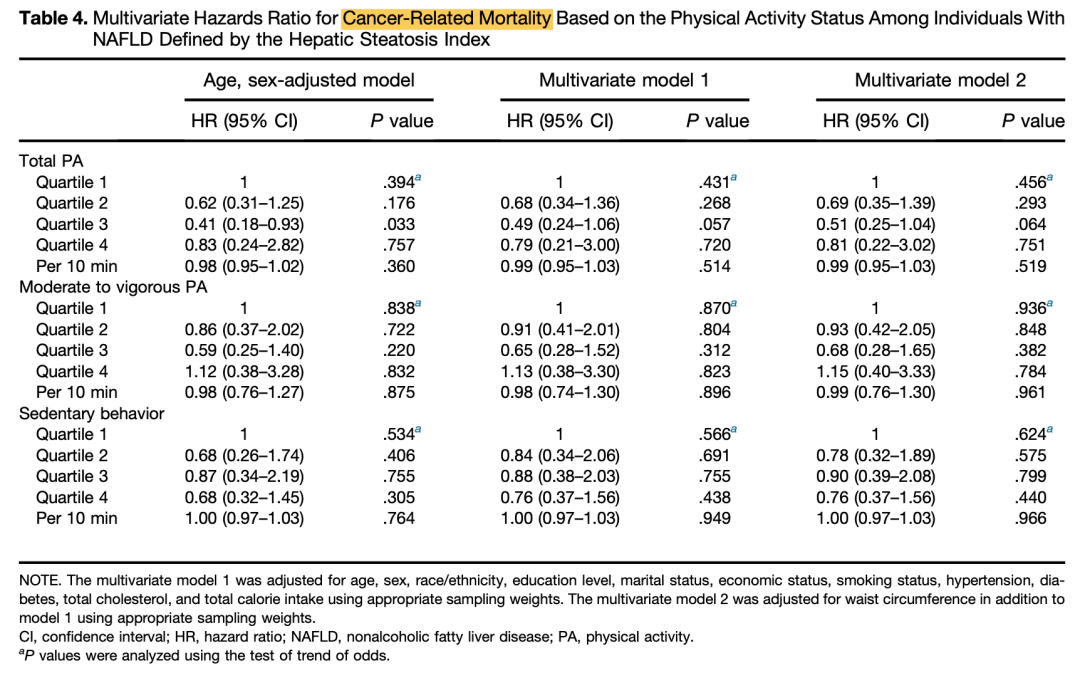
(引自报告幻灯)
久坐和低体力活动与NAFLD独立相关。久坐与NAFLD高患病率相关,心肺耐力(CRF)较低与全因病死率较高相关。2019年挪威HUNT研究纳入15781例成人(女性52%,年龄范围19~95岁),横断面分析患病率。受试者自我报告的静坐时间(SB)分为3层,研究者通过使用性别特异性算法(包括年龄、腰围、个人运动机能指数和静息心率)的非运动模型和NAFLD的存在评估CRF。与对照组(SB≤4 h/d)相比,报告SB≥7 h/d的受试者患NAFLD的可能性高34%(OR=1.34;95%CI:1.19~1.50),SB每增加 1 小时/天,患NAFLD的可能性显著增加4%(95%CI:3%~6%)。(表8)。5611例NAFLD患者队列平均随访9.4年,353例发生全因死亡,估计的基线CRF水平显著影响生存率。与高CRF者相比,低CRF的受试者全因死亡率增加52%(HR=1.52;95%CI:1.10~2.06)(表9)。
表8. 根据久坐行为分层的NAFLD患病率的调整优势比(OR)和95%置信区间(CI)
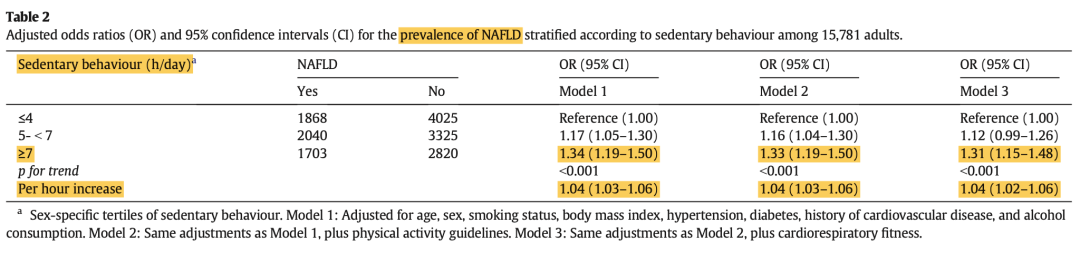
(引自报告幻灯)
表9. 根据久坐行为分层的全因死亡率的OR和95%CI

(引自报告幻灯)
三、小结
治疗NAFLD的首要目标为减肥和改善胰岛素抵抗,预防和治疗代谢综合征、T2DM及其相关并发症,从而减轻疾病负担、改善患者的生活质量并延长寿命。减少体重和腰围是预防和治疗NAFLD及其并发症最为重要的治疗措施。对于超重、肥胖,以及近期体重增加和“隐性肥胖”的NAFLD患者,建议通过健康饮食和加强锻炼的生活方式教育纠正不良行为。
参考文献:
1. GBD 2017 Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017 [published correction appears in Lancet. 2019 Jun 22;393(10190):e44]. Lancet. 2018;392(10159):1789-1858. doi:10.1016/S0140-6736(18)32279-7
2. Eslam M, et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. J Hepatol. 2020 Jul;73(1):202-209.
3. 非酒精性脂肪性肝病防治指南(2018更新版)
4. Promrat K, Kleiner DE, Niemeier HM, Jackvony E, Kearns M, Wands JR, Fava JL, Wing RR. Randomized controlled trial testing the effects of weight loss on nonalcoholic steatohepatitis. Hepatology. 2010 Jan;51(1):121-9.
5. Musso G, Cassader M, Rosina F, Gambino R. Impact of current treatments on liver disease, glucose metabolism and cardiovascular risk in non-alcoholic fatty liver disease (NAFLD): a systematic review and meta-analysis of randomised trials. Diabetologia. 2012 Apr;55(4):885-904.
6. Keating SE, Hackett DA, George J, Johnson NA. Exercise and non-alcoholic fatty liver disease: a systematic review and meta-analysis. J Hepatol. 2012 Jul;57(1):157-66.
7. Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, Torres-Gonzalez A, Gra-Oramas B, Gonzalez-Fabian L, Friedman SL, Diago M, Romero-Gomez M. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Gastroenterology. 2015 Aug;149(2):367-78.e5; quiz e14-5.
8. Katsagoni CN, Papatheodoridis GV, Ioannidou P, Deutsch M, Alexopoulou A, Papadopoulos N, Papageorgiou MV, Fragopoulou E, Kontogianni MD. Improvements in clinical characteristics of patients with non-alcoholic fatty liver disease, after an intervention based on the Mediterranean lifestyle: a randomised controlled clinical trial. Br J Nutr. 2018 Jul;120(2):164-175.
9. Kim D, Murag S, Cholankeril G, Cheung A, Harrison SA, Younossi ZM, Ahmed A. Physical Activity, Measured Objectively, Is Associated With Lower Mortality in Patients With Nonalcoholic Fatty Liver Disease. Clin Gastroenterol Hepatol. 2021 Jun;19(6):1240-1247.e5.
10. Croci I, Coombes JS, Bucher Sandbakk S, Keating SE, Nauman J, Macdonald GA, Wisloff U. Non-alcoholic fatty liver disease: Prevalence and all-cause mortality according to sedentary behaviour and cardiorespiratory fitness. The HUNT Study. Prog Cardiovasc Dis. 2019 Mar-Apr;62(2):127-134.

专家简介
徐京杭
北京大学第一医院 感染疾病科 副主任
医学博士,副主任医师,副教授,硕士生导师
美国国立卫生研究院/国立癌症研究所访问学者
中华医学会肝病学分会青年学组副组长
中华医学会肝病学分会肝纤维化、肝硬化门脉高压学组副组长
中华医学会肝病学分会脂肪肝和酒精性肝病学组委员
中华医学会感染病学分会青年委员
北京医学会肝病学分会委员
北京中西医结合学会传染病专业委员会副主任委员
往期推荐

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
访谈
专家访谈
其他肝病
发表评论
全部评论