Gut丨梁廷波教授团队:基于CyTOF技术构建肝癌和胰腺癌早期液体诊断模型
—— 作者: 时间:2023-03-26
阅读数:
33
编者按:肝细胞癌(HCC)和胰腺癌(PDAC)是常见的恶性肿瘤,其特征是发病隐匿,大部分的患者临床诊断和治疗相对延迟。因此,迫切需要用于肿瘤筛查和早期检测的新工具。新兴的液体活检技术试图取代传统的血清学筛查方法或组织活检。例如,在HCC中,血清代谢组5-羟甲基胞嘧啶和ctDNA在检测患者HCC方面表现出良好的性能,曲线下面积(AUC)在0.8至0.9.9-11之间。这些策略已经证明了它们在肿瘤检测领域的优势和潜力。然而,目前还没有公认的用于肿瘤检测的液体活检策略。
近年来,越来越多的证据表明,肿瘤的发生和发展伴随着全身免疫紊乱和外周免疫细胞的改变。因此,循环的免疫分析可能有助于检测肿瘤;然而,迄今为止还没有这样的成功尝试。
质谱流式细胞技术(CyTOF)是一种新开发的技术,可以分析免疫细胞的组成和数量。为了测试外周血免疫细胞在肿瘤检测中的价值,浙江大学医学院附属第一医院梁廷波教授团队近日完成了一项大样本、多中心的临床研究,旨在通过CyTOF建立HCC和PDAC的液体活检诊断模型,以便更好地应用于临床。该项研究成果已在Gut杂志在线发表。

文章发表封图
(doi: 10.1136/gutjnl-2022-327496)
研究方法
该项研究共纳入2019年10月至2022年7月期间来自15个中心的2348例受试者,进行了CyTOF分析,其中包括1131例肝病患者、584例胰腺病患者以及633名健康志愿者。肝脏组包括790例HCC患者和341例良性肝病患者。胰腺组包括376例PDAC患者和208例良性胰腺疾病患者。两组共用健康对照组。通过随机森林算法构建诊断模型,并在亚组中进行验证。
所有受试者均接受超声、CT或MRI检查,通过病理学或临床诊断确定HCC,根据临床指南通过病理学确定PDAC。组织病理学进一步证实了接受手术切除的患者的诊断。肝脏良性疾病包括但不限于血管瘤(164例)、囊肿(66例)和局灶性结节性增生(71例)。胰腺良性疾病包括但不限于神经内分泌肿瘤(28例)、囊性肿瘤(120例)、自身免疫性胰腺炎(9例)和慢性胰腺炎(18例)。
在常规体检期间,采集健康志愿者的外周血样本。通过回顾体检结果和查阅病史来确定他们的健康状况。排除标准如下:有癌症相关治疗史;急性感染;过去6年内的输血?月;过去2年内影响外周血成分的药物的使用,如重组人红细胞生成素和白介素等;复发性肿瘤;器官失代偿功能障碍;免疫缺陷综合征;血液系统癌前疾病;接受免疫抑制治疗,并证实有凝血障碍。
研究结果
为了揭示外周免疫的特征,研究人员对所有采集的PBMC样本进行了CyTOF分析。对所有CyTOF数据进行预处理,并在门控后保留活的单个免疫细胞(CD45+)以进行进一步分析。他们从每组中随机选择病例,包括81例HCC、50例良性肝病、50例PDAC、50例胰腺良性疾病和50名健康志愿者。然后,根据CyTOF分析结果绘制了热图。分析显示(图1),在肝脏组和胰腺组中,有无恶性肿瘤的受试者的一些细胞亚群存在显著差异。其中,与“非HCC”(包括健康志愿者和患有肝脏良性疾病受试者)队列相比,HCC患者表现出:幼稚CD4+T细胞、幼稚CD8+T细胞、效应CD8+T淋巴细胞和记忆B细胞的水平显著降低;而CD39+幼稚CD4+T细胞、中央记忆CD4+T淋巴细胞、双阳性T细胞、浆细胞和单核细胞的水平显著升高。有趣的是,一些亚群显示出随着肿瘤进展而逐渐加重的相关变化,例如,NK细胞水平的增加随着HCC患者的分期变化(从BCLC 0期到C期)更为显著,而CCR4+CD20–B细胞簇则与之相反。
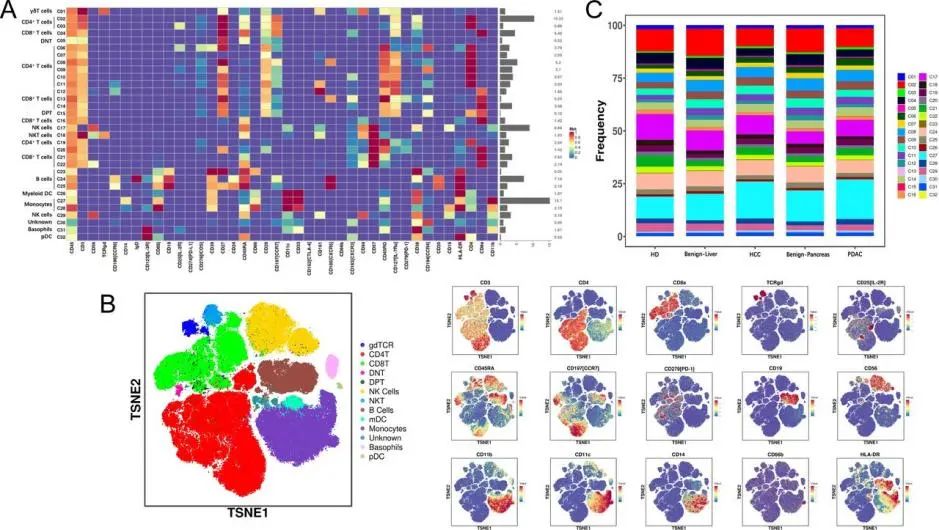
图1. 不同队列的CyTOF数据分析热图
(A) 外周免疫细胞中表达的标志物正常表达的热图。热图的左侧和右侧分别显示了各种免疫细胞的类型和比例。(B)来自281个选定病例的CyTOF数据和用于注释各种免疫细胞的部分选定经典细胞表面标志物的可视化t-SNE图。(C)不同组中免疫细胞亚群的频率图。
研究人员确定了HCC和PDAC引起的系统免疫紊乱,并基于构建的模型计算了外周血免疫评分(PBIScore)。PBIScore在检测HCC和PDAC方面表现出良好的性能,在验证队列中灵敏度和特异性均在80%左右。他们通过将PBIScore与甲胎蛋白或碳水化合物抗原19-9结合,进一步建立了一种整合的PBIS-core(iPBIScore)。HCC的iPBIScore在训练、内部验证和外部验证队列中的曲线下面积(AUC)分别为0.99、0.97和0.96(见图2)。同样,PDAC的iPBIScore在训练、内部验证和外部验证队列中分别显示出0.99、0.98和0.97的AUC(见图3)。
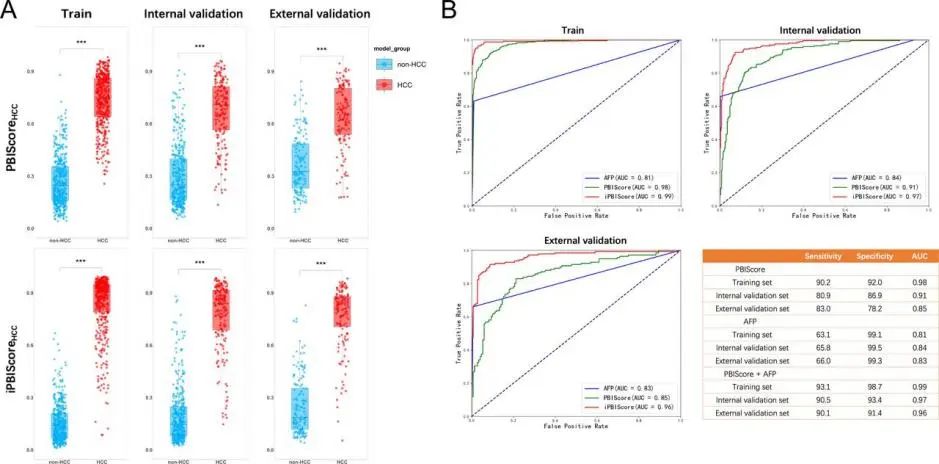
图2. HCC检测模型的开发和验证
(A)训练队列、内部验证队列和外部验证队列中患有或不患有HCC的受试者的PBIScore和iPBIScore。(B)AFP、PBIScore和iPBIScore在训练队列、内部验证队列和外部验证队列中用于HCC检测的ROC曲线。
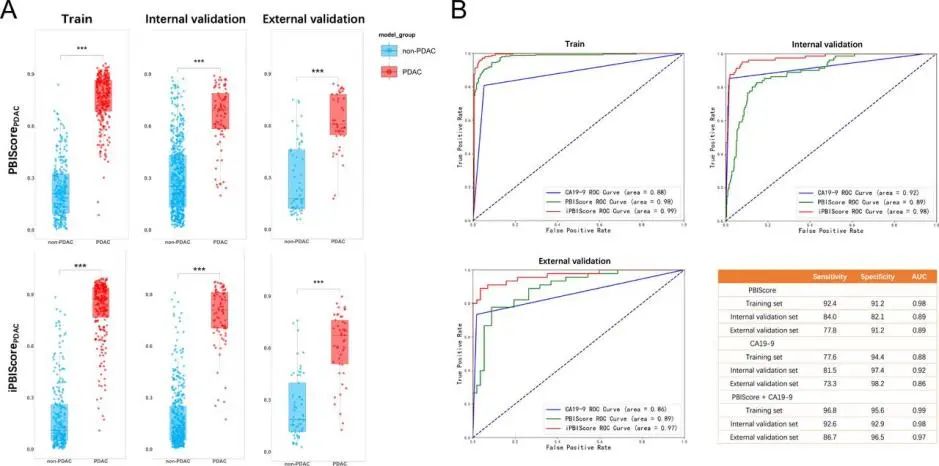
图3. PDAC检测模型的开发和验证
(A)训练队列、内部验证队列和外部验证队列中有或没有PDAC的受试者的PBIScores和iPBIScore。(B)训练队列、内部验证队列和外部验证队列中检测PDAC的CA19-9、PBIScore和iPBIScore的ROC曲线。
早期肿瘤和肿瘤标志物阴性的肿瘤的检测在临床实践中更具挑战性。为了测试该模型在这些人群中的作用,研究者进一步分析了模型在HCC和PDAC不同阶段的性能。总的来说,在癌症和非癌症之间的差异较不同肿瘤分期之间的差异更为显著。同时,在早期肿瘤检测方面,该模型同样显示出良好的性能。研究人员在BCLC 0期或A期的HCC患者中测试了基于PBIScore的模型,结果表明,与AFP(AUC为0.81)相比,PBIScore模型和iPBIScore模型的AUC值分别为0.90和0.96(图4A);在可切除PDAC患者中,与CA19-9(AUC为0.88)相比,PBIScore模型和iPBIScore模型的AUC值分别为0.89和0.95(图4B)。
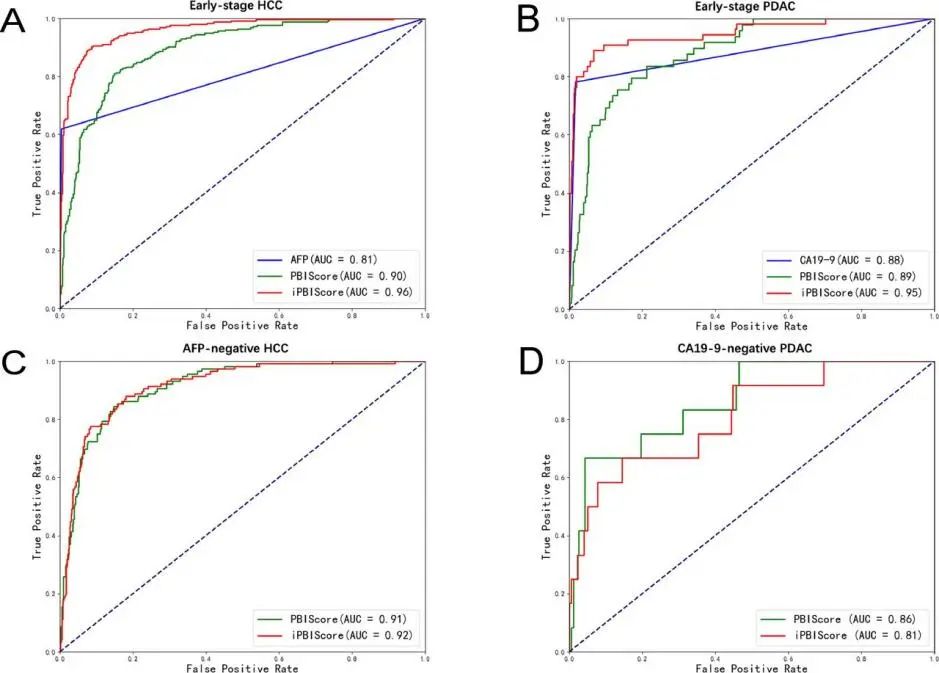
图4. 肿瘤检测模型在早期患者或肿瘤标志物水平正常的患者中的表现
(A)AFP、PBIScore和iPBIScore的ROC曲线用于HCC BCLC 0-A期患者的肿瘤检测,其AUC分别为0.81、0.90和0.96。(B)CA19-9、PBIScore和iPBIScore的ROC曲线用于可切除PDAC患者的肿瘤检测,显示AUC分别为0.88、0.89和0.95。(C)PBIScore和iPBIScore在AFP阴性HCC中用于肿瘤检测的ROC曲线分别显示出0.91和0.92的AUC。(D)PBIScore和iPBIScore在CA19-9阴性PDAC中用于肿瘤检测的ROC曲线,显示AUC分别为0.86和0.81。
研究结论
该项研究结果表明,外周免疫细胞亚群的改变可以帮助肿瘤的筛查和检测,有望为HCC和PDAC提供一个可靠的液体活检检测模型。
END
原文链接:Zhang Q, Ye M, Lin C, et al. Mass cytometry-based peripheral blood analysis as a novel tool for early detection of solid tumours: a multicentre study. Gut Published Online First: 16 September 2022. doi: 10.1136/gutjnl-2022-327496

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
访谈
专家访谈
肝癌
发表评论
全部评论
