鲁凤民教授:全生物外泌体介导的靶向HBV DNA的基因编辑技术,为实现乙肝功能性治愈带来希望!
—— 作者: 时间:2023-04-15
阅读数:
136
HBV感染是人类健康的重大挑战,在中国有超过8000万慢性乙型肝炎(Chronic Hepatitis B,CHB)患者[1-2],其中超过3000万患者需要被立即治疗,在这3000多万人中,仅仅有17%的人正在接受治疗,这和WHO的目标相距甚远[3]。目前CHB的治疗方式均非直接靶向乙肝病毒的遗传基因组,即cccDNA(covalently closed circle DNA)和整合HBV DNA(Integrated HBV DNA),这也是导致CHB无法完全治愈的主要原因[4]。
CRISPR/Cas9是一种强大的基因编辑工具,其可以实现靶位点基因的删除或插入从而破坏特定的基因组。那么是否可以应用CRISPR/Cas9破坏cccDNA,删除整合HBV DNA呢?北京大学鲁凤民教授在第二届肝病创新论坛上介绍了其实验室以全生物外泌体为载体递送基因编辑系统CRISPR/Cas9(Clustered Regularly Interspaced Short Palindromic Repeats/ CRISPR-associated protein 9),通过基因编辑技术破坏HBV DNA的最新进展。
cccDNA是一种超级环状DNA,在感染的细胞中由HBV基因组松弛环状部分双链DNA (rcDNA)转换而来,是HBV复制的来源库,是慢性病毒持续感染和慢性乙肝难以治愈的主要病毒学因素。
整合HBV DNA可以表达HBsAg,而血清学HBsAg水平是CHB治愈的关键标志物,尤其是在乙肝病毒e抗原(HBeAg)阴性阶段,整合HBV DNA更是HBsAg的主要来源。所以整合HBV DNA的存在是另一个不能完全治愈CHB的原因,也是CHB患者发展为肝细胞癌(Hepatocellular Carcinoma,HCC)的主要原因。
CRISPR/Cas9在HBV中的研究进展
1
单一gRNA的研究
2014年第一篇利用CRISPR/Cas9 靶向cccDNA的研究被报道[5],早期研究仅设计了单个gRNA来引导Cas9蛋白剪切HBV cccDNA,断裂的DNA往往会立即被DNA损伤修复系统重新连接。由此以来,当设计靶向pre-C/C区域的gRNA,e抗原的表达将会被破坏;当设计靶向S和P区域时的gRNA,由于它们的开发阅读框是重叠的,S蛋白和P蛋白的表达将会被破坏。但是,仅通过单一的gRNA,仅会有一个病毒蛋白的表达被破坏,重新环化后的其他病毒基因可以继续进行转录、表达和分泌(图1[6])。因此,单一gRNA 介导的基因编辑可能不会有效地破坏cccDNA。例如,靶向pre S/S区域,HBsAg的分泌急速下降,但是HBeAg却仍然维持在一个较高的水平,当靶向pre C/C区域时,也会发生类似的现象。
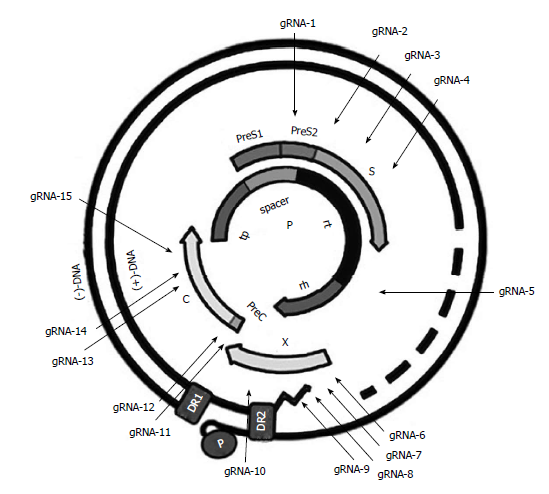
图1. 位于乙型肝炎病毒基因组中的gRNA靶向序列的说明
2
双gRNA的研究
如果将两种不同的gRNA递送进入细胞,那么每一种gRNA将会各自引导Cas9蛋白结合并在不同位点剪切cccDNA。假如这种剪切同时发生,两个剪切位点中间的片段将会被删除,剩余的cccDNA即便是被重新连接在一起形成更小的环状DNA,但由于部分基因被删除,这个小环状DNA不再能支持HBV DNA的复制(图2)。利用这一点设计一段覆盖两个剪切位点的PCR扩增引物,如果中间的片段没有被删除,那么较长的基因片段将会被扩增,如果中间的片段被删除,那么剩余的小片段会被扩增,然后应用琼脂糖凝胶电泳检测扩增产物,以确定cccDNA是否被破坏。
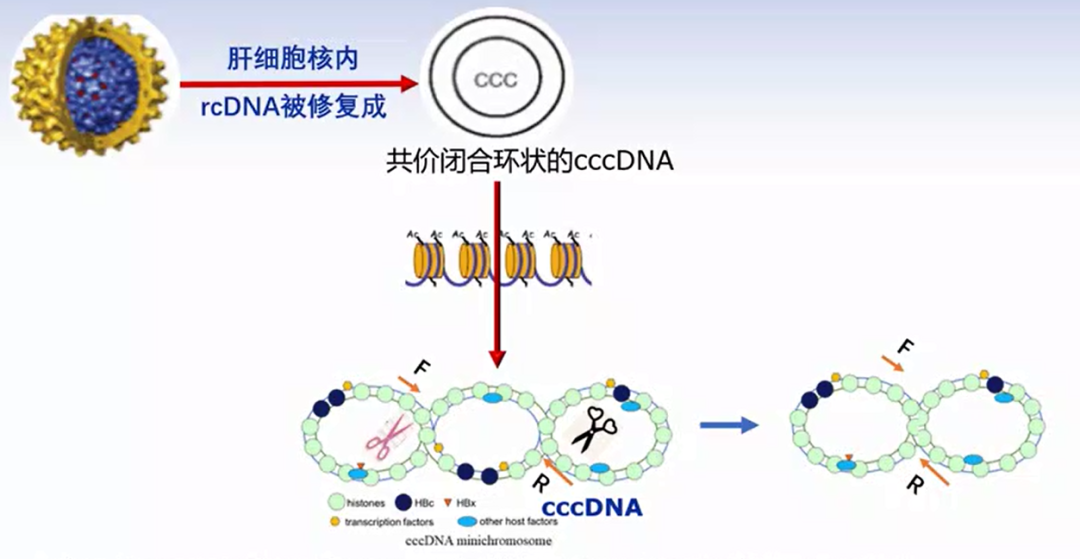
图2. 双gRNA将cccDNA剪切后连接在一起形成更小的环状DNA
Wangjie[6]等设计了不同的gRNA并尝试不同的双gRNA组合,数据显示当应用双gRNA时, HBeAg和HBsAg浓度水平均同时大幅下降,双gRNA表现优于单一gRNA。在所有组合中,gRNA5+gRNA12表现尤其突出,扩增产物中几乎没有检测到全基因片段,意味着两个剪切位点之间的片段已经被删除,也意味着几乎所有的cccDNA都被破坏了(图3)。
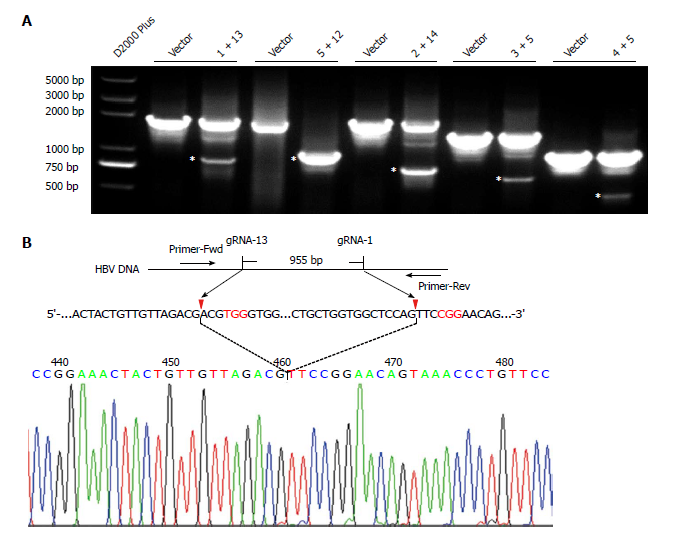
图3. 双gRNA剪切后的基因片段检测结果
3
gRNA-miRNA-gRNA三联体的研究
为了更好地清除cccDNA,Wangjie(王杰)等将人工设计的靶向cccDNA转录本序列的miRNA放在上述两个gRNA中间形成三联体[7]。在表达Cas9蛋白的同时,转录非成熟的gRNAa-miRNA-HBV-gRNAb,接着利用细胞内源的Drosha和DGCR8释放pre-miR-HBV和gRNA,然后pre-miRNA进入细胞质形成成熟的HBV特异性miRNA,阻滞HBV的转录和翻译。同时,被释放的 gRNA与cas9蛋白结合并破坏有同样靶序列的cccDNA或者整合HBV DNA(图4)。
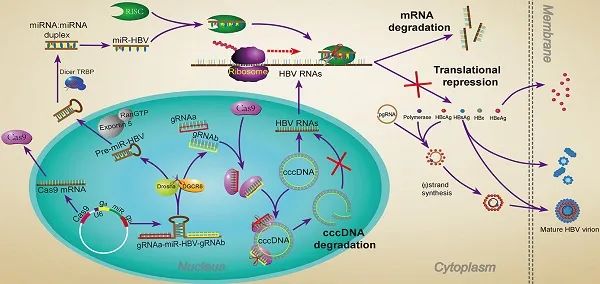
图4. gRNA-miRNA-gRNA三联体作用机制示意图
三联体应用的相关动物实验展示出令人兴奋的结果,研究使用小鼠模型,通过尾静脉注射三联体,对小鼠血清中的HBsAg进行定量检测,结果显示3-H38-12组表现突出,第7天的时候几乎检测不到HBsAg,肝组织切片中几乎没有发现HBcAg蛋白,这表明cccDNA已经完全被破坏掉,CRISPR/Cas9可以有效破坏HBV DNA(图5)。
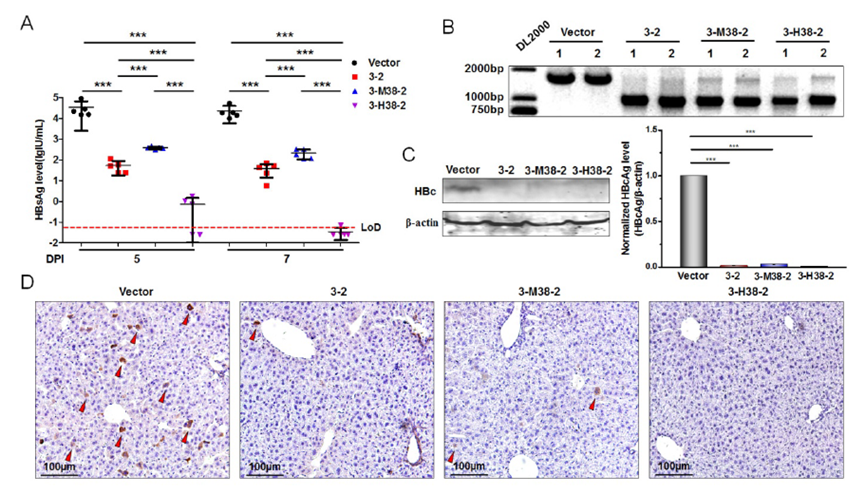
图5. 小鼠血清及组织中HBsAg/HBcAg检测结果
递送系统-外泌体
对于体内基因编辑治疗来说,递送非常重要,外泌体是众所周知的递送系统,可以将DNA、RNA或蛋白从一个细胞递送到另外一个细胞,发挥着介导细胞间通讯的重要功能。那么,当CRISPR/Cas9基因编辑系统被递送进宿主细胞后,所分泌出来的外泌体中是否含有Cas9蛋白和gRNA,并将其递送到周围其他细胞中?
Chen ran(陈然)等[8]将CRISPR/Cas9和以HBV为靶点的gRNA共同转染进可支持HBV复制的HepAD38细胞,一组不加GW4869,另一组加入GW4869进行处理,并定量检测上清中的HBsAg。结果发现,即使转染效率只有10%左右,也可以抑制高达30%的HBV复制,但是在外泌体抑制剂GW4869的处理下,CRISPR/Cas9抑制HBV复制的强大能力明显减弱,这表明内源性外泌体一定程度上参与外周细胞内的基因编辑。
为了进一步证实外泌体可以将编辑工具运载到周围细胞中,首先需要确认外泌体中是否含有完整的gRNA和Cas9。
Chen等将HPV特异CRISPR/Cas9质粒和HBV特异CRISPR/Cas9质粒分别转染进Hela和HuH7细胞,对其分泌的外泌体进行理化表征,并通过RT-PCR和WB分别检测Hela和HuH7外泌体中gRNA和Cas9蛋白水平,结果证实两种细胞的外泌体中均存在完整的gRNA和Cas9蛋白(图6)。
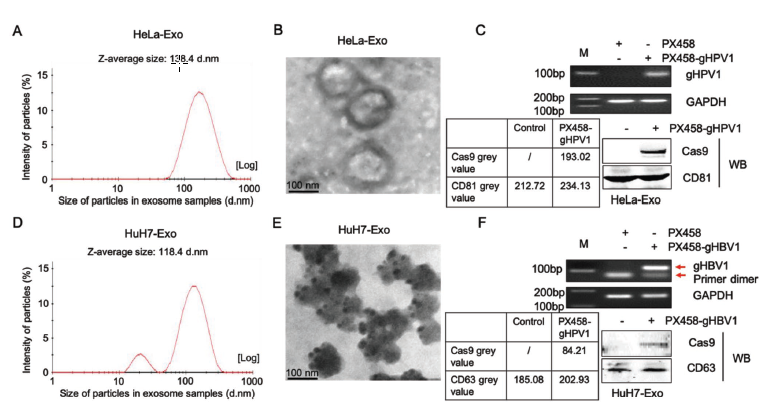
图6. Hela和HuH7外泌体表征及gRNA和Cas9蛋白水平结果
将Cas-GFP融合蛋白质粒进行细胞转染,对HeLa和HuH7细胞分别进行免疫荧光染色,激光扫描共聚焦显微镜下观察到Cas 9-GFP和外泌体标志物CD63蛋白存在共定位现象,进一步表明了Cas9蛋白可以进入外泌体中(图7)。
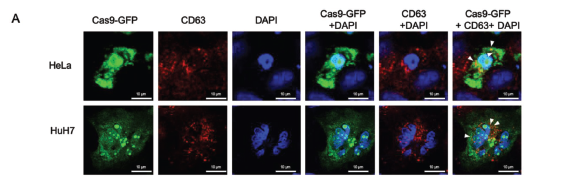
图7. 共聚焦显微镜Cas9-GFP和CD63蛋白定位图
载有活性物质的外泌体是否可以将其递送进入外周细胞内呢?
将纯化的载有Cas9蛋白的外泌体添加到加或不加蛋白翻译抑制剂CHX处理的HuH7细胞培养上清中。在添加后12和24小时,共聚焦显微镜下观察Cas9-GFP的定位。结果显示,加CHX组Cas9-GFP的表达没有明显降低,转染后12 h外泌体可以运载Cas9-GFP蛋白进入外周细胞细胞质中,转染后24 h可进入细胞核中,这对CRISPR/Cas9 发挥其基因编辑作用非常重要(图8)。
将含有Cas9和两种HBV特异性gRNA的外泌体纯化,加入到1.2×HBV质粒转染后的HuH7细胞中培养48 h,提取基因组DNA,PCR扩增结果显示PCR产物含有两个gRNAs编辑位点之间的序列被移除的HBV DNA片段,这说明外泌体运载的CRISPR/Cas9基因编辑系统可进入外周细胞并发挥活性作用破坏细胞中的HBV DNA(图8)。
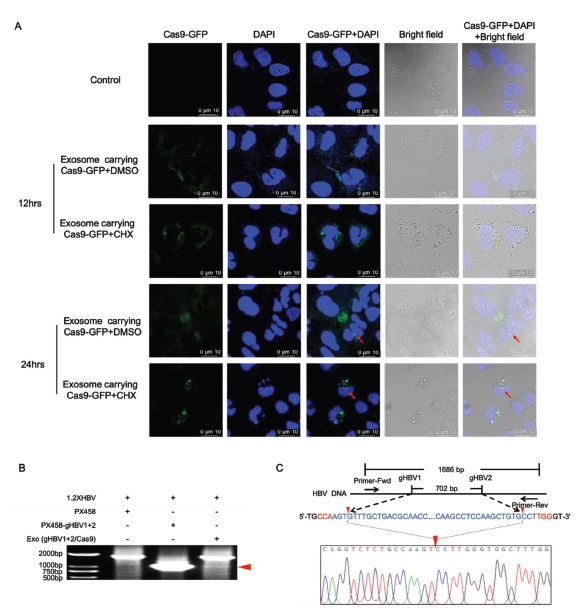
图8.共聚焦显微镜下观察Cas9-GFP蛋白定位图/外泌体递送的基因编辑活性检测
为了进一步证明携带gRNA和Cas9蛋白的内源性外泌体可以将CRISPR/Cas9系统的基因编辑活性传递给周围细胞,将共转染PX458-gHBV1和PX458-gHBV2质粒的HuH7细胞作为供体细胞,1.2×HBV表达质粒转染的HuH7细胞作为受体细胞,转染后48小时,供体细胞和受体细胞在同一培养皿中共培养。共培养48小时后,从两个细胞中提取总DNA,基于PCR的克隆测序分析显示,PCR扩增后出现的小片段是两个gRNAs编辑位点之间的序列被移除的HBV DNA,进一步证明外泌体转运的CRISPR/Cas9可以进入外周细胞并发挥基因编辑作用。采用Hela细胞和HPV特异性的gRNA重复了同样的实验,也得到了相同的结果。
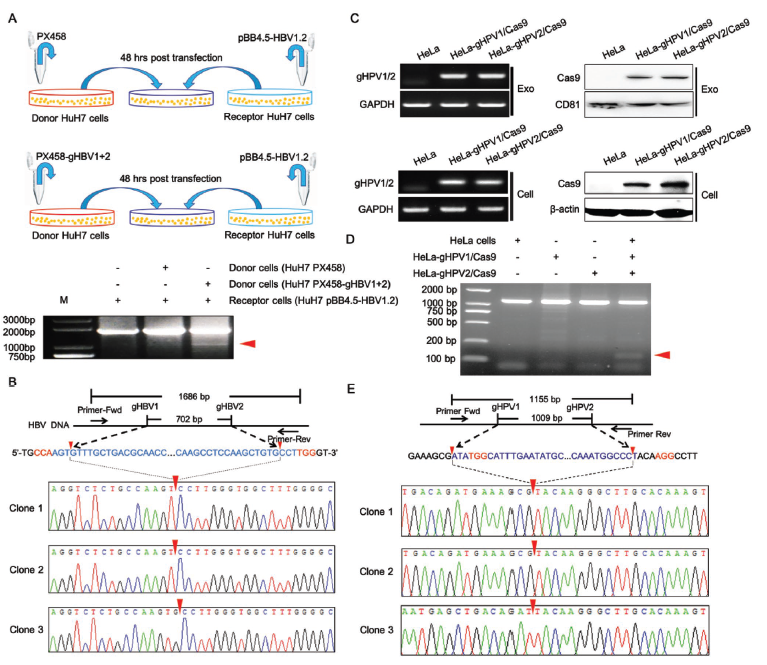
图9.实验操作示意图/外泌体递送的Cas9和gRNA的基因编辑活性检测
除上述两种细胞外,他们同时也探索了生物工程细胞在生产携带功能性gRNA和Cas9蛋白的外泌体方面的潜在应用,结果显示两种工程细胞Vero和CHO外泌体也可以运载CRISPR/Cas9进入靶细胞的细胞核进一步破坏细胞的HBV DNA,这为内源性外泌体可能被用作传递CRISPR/Cas9系统基因编辑活性的载体提供了更高的可能性。如果CRISPR/Cas9基因编辑系统和外泌体递送系统发展到临床应用,乙肝功能性治愈未来可期!
参考文献:
[1] World Health Organzation. Global Hepatitis Report 2017.Geneva:WHO.2017.
[2] GBD 2019 Hepatitis B Collaborators. Lancet Gastroenterol Hepatol. 2022.
[3] Mehlika Toy, David Hutton , Jidong Jia , Samuel So. Costs and health impact of delayed implementation of a national hepatitis B treatment program in China. J Glob Health. 2022 Jul 8.
[4] Fabien Zoulim, Fanny Lebosse, Massimo Levrero. Current treatments for chronic hepatitis B virus infections. Current Opinion in Virology 2016, 18:109–116.
[5] Su-Ru Lin, Hung-Chih Yang, Yi-Ting Kuo. The CRISPR/Cas9 System Facilitates Clearance of the Intrahepatic HBV Templates In Vivo. Mol Ther Nucleic Acids. 2014 Aug 19;3(8):e186.
[6] Jie Wang, Zhong-Wei Xu, Shuang Liu. Dual gRNAs guided CRISPR/Cas9 system inhibits hepatitis B virus replication. World J Gastroenterol 2015 August 28; 21(32): 9554-9565.
[7] Jie Wang, Ran Chen, Ruiyang Zhang. The gRNA-miRNA-gRNA ternary cassette combining CRISPR/Cas9 with RNAi approach strongly inhibits hepatitis B virus replication. Theranostics 2017, Vol. 7, Issue 12.
[8] Ran Chen, Hongxin Huang, Hui Liu. Friend or Foe? Evidence Indicates Endogenous Exosomes Can Deliver Functional gRNA and Cas9 Protein. Small 2019, 15, 1902686.

专家简介
鲁凤民
北京大学基础医学院病原生物学系及北京大学感染病中心主任、北京大学肝病研究所教授。
研究方向为乙型肝炎病毒及相关肝病、肝癌的发病机制和诊断标志物的研发。实验证实HBV RNA病毒样颗粒的存在,推进了血清HBV RNA的临床应用;明确了血清GP73是不同病因慢性肝病肝硬化的可靠诊断指标;提出肝脏弹性指数测定(LSM)是反映肝脏炎症活动度的评价指标,进一步拓展了LSM在慢性肝脏疾病评估中的应用。作为课题负责人先后承担了国家“传染病防治”科技重大专项、国家自然基金面上项目、北京市科委重大项目以及“863”、“973”计划项目等课题二十余项,作为第一完成人获得中华医学科技二等奖一项,作为完成人获得国家科技进步二等奖两项。在国内外期刊发表研究论文近二百篇,被引用近万次。获得授权发明专利18项。

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
述评/点评
专家访谈
乙肝
发表评论
全部评论
