唐时幸教授:我国HIV感染分子流行病学研究进展
—— 作者: 时间:2023-05-03
阅读数:
54
编者按
抗病毒治疗药物的出现和应用将艾滋病变为一种可以治疗但目前尚难以彻底治愈的慢性疾病。全国艾滋病病毒分子流行病学调查结果显示,我国艾滋病病毒(HIV)流行株种类迅速增加,显示出更加复杂、多样化的特征,且主要的流行区域正在进一步扩大,我国主要流行的重组型病毒(CRF),如CRF01_AE和CRF07_BC,已覆盖了全国31个省市自治区,HIV新的重组型病毒不断出现。因此,艾滋病防控工作更加复杂,形势依然严峻。近日,在第二届大湾区肝病国际高峰论坛暨2023国际消除病毒性肝炎大会上,南方医科大学公共卫生学院唐时幸教授从分子流行病学角度,系统阐述了HIV-1基因亚型和新型重组型病毒演变的现状、特点和趋势,并重点就HIV-1基因型对疾病进展和治疗效果的影响进行了观点分享。本刊特将报告内容整理如下,以飨读者。
我国HIV-1基因型的演变
HIV-1以病毒基因变异快、病毒亚型和重组病毒多样性为显著特征,与HIV感染的诊断、疫苗开发和临床治疗管理等密切相关,HIV-1亚型的组成和分布反映了HIV-1感染的区域性流行特征。在中国HIV-1流行的早期阶段,B亚型占主导地位。20世纪90年代初,从印度引入中国的C亚型与B亚型在云南发生重组形成CRF07_BC和CRF08_BC重组型病毒,并逐渐成为我国主要的HIV流行病毒,随后通过吸毒者在中国传播[1]。
近年来,我国各省市又陆续发现多种HIV新型重组病毒,CRF55_01B等新重组病毒不断出现,代表HIV基因型变化的新趋势(图1),但目前主要是以CRF01_AE、CRF07_BC和CRF08_BC以及B亚型为主(图2)[1-3]。
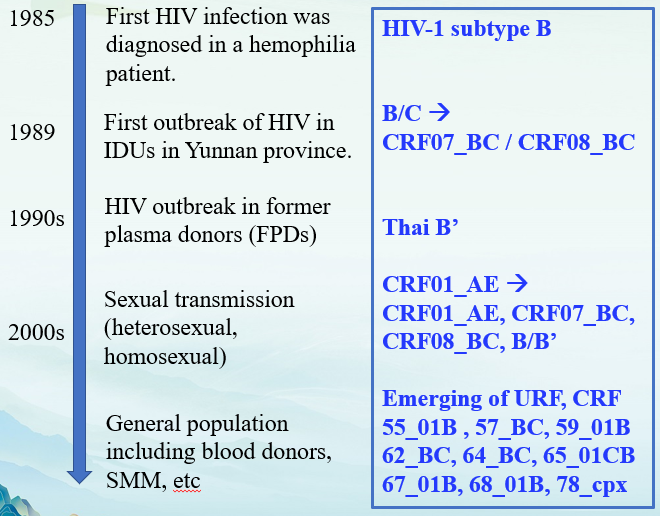
图1. 我国HIV-1基因型变化
(引自讲者幻灯)

图2. 中国HIV-1基因型分布[2]
HIV-1基因型与疾病进展
全国第四次HIV分子流行病学调查发现,我国以CRF07_BC和CRF01_AE为主形成的分子流行簇占总流行簇人数的83%。以异性为主的传播人群存在着四个主要的分子流行簇,主要由CRF07_BC和CRF01_AE病毒分别形成的两个大分子流行簇,以及由CRF08_BC和B亚型病毒形成的两个小簇。
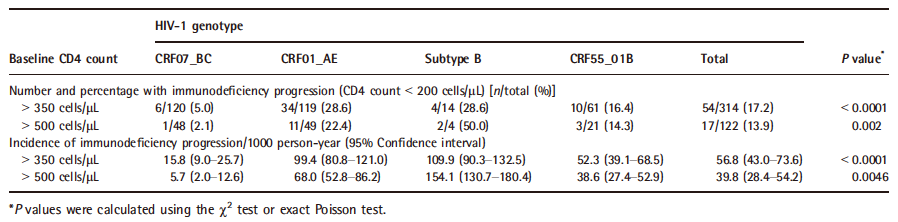
HIV-1不同基因型传播性研究数据显示[4-5],CRF07_BC变异影响了病毒组装释放、复制和病毒感染力,传播更快,但感染者疾病进展略缓慢,对抗病毒治疗反应更好。总的来说,HIV-1基因型传播性:CRF07>CRF55>CRF01>B亚型(表1);B亚型流行较早,进化速率趋势较平稳;CRF55_01B在2007年左右快速增长;CRF59_01B流行较晚,2010年前缓慢增长,2012年后增长较快(表1)[6]。但HIV-1 B亚型、CRF01_AE和CRF55_01A比CRF07_BC感染者更容易进展到免疫抑制或艾滋病(表2)[7]。
表1. HIV-1不同基因型传播性研究 [6]

表2. HIV-1基因型与疾病进展的队列研究 [7]
HIV-1基因型对抗病毒治疗效果的影响
2014年,中国台湾的研究提出CRF07_BC病毒感染者的病毒载量明显低于B亚型感染者,而且该病毒株在人外周血单核细胞(PBMCs)的复制能力亦低于B亚型病毒株[8]。既往流行病学研究结果显示,CRF07_BC病毒Gagp6蛋白在Alix蛋白结合序列存在连续7个氨基酸缺失(PIDKELY)的特异性突变,该突变为越来越多的CRF07_BC病毒株所特有[9]。而且Gagp6蛋白缺失突变可能影响病毒的组装和释放以及感染和复制能力[10],带有Gagp6突变的HIV-1 CRF07_BC Gag蛋白,免疫动物后可以诱导更强的CD4+和 CD8+T细胞免疫反应[11]。HIV-1 CRF07_BC病毒感染者比B亚型、CRF01_AE和CRF55_01A感染者对抗逆转录病毒治疗(ART)的反应更好。
综上所述,HIV-1的变异是影响病毒表型变化的分子基础。HIV-1 Gagp6蛋白缺失7个氨基酸能够抑制病毒释放与成熟进程,并导致病毒感染力和复制缺陷,结果与临床上CRF07 BC病毒表型变化相关,可能是引起临床上CRF07 BC患者CD4+细胞数较高,病毒载量低,疾病病程延缓的原因之一。CRF07_BC病毒Gagp6蛋白30-36位氨基酸缺失,直接影响Gag蛋白与宿主Alix蛋白的相互作用,导致病毒组装释放减少,病毒复制减缓,感染力降低(图3)。此外,病毒RT蛋白的变异也直接影响病毒复制[12]。
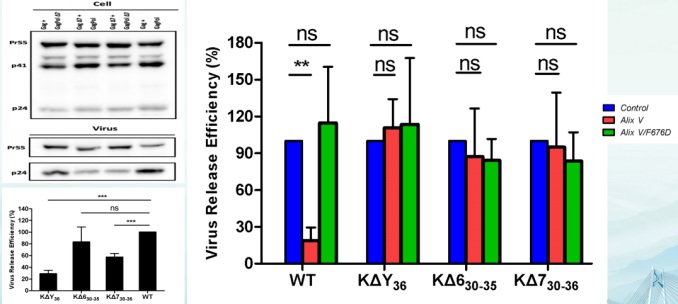
图3. p6Gag蛋白变异影响病毒释放、复制和感染力[10]
抗病毒治疗对HIV-1体液免疫的影响
目前,HIV-1感染已从一种致死性疾病转变为一种可治疗、可控的慢性疾病。接受抗病毒治疗后,HIV感染者预期寿命接近正常人。目前国际上共有6大类30多种ART药物(包括复合制剂),分别为核苷类反转录酶抑制剂(NRTIs)、 非核苷类反转录酶抑制剂(NNRTIs)、蛋白酶抑制剂(PIs)、整合酶链转移抑制剂(INSTIs)、膜融合抑制剂(FIs)及CCR5辅助受体抑制剂。新型、长效抗病毒药物可能极大简化治疗方法,提高抗病毒治疗效果,如每月注射一次长效抗HIV药物(CAB/RPV);HIV-1衣壳抑制剂GS-6207具有强大的抗病毒活性;皮下注射潜在给药间隔可达每6个月一次;植入型抗病毒药在体内有效浓度可维持至少12个月。
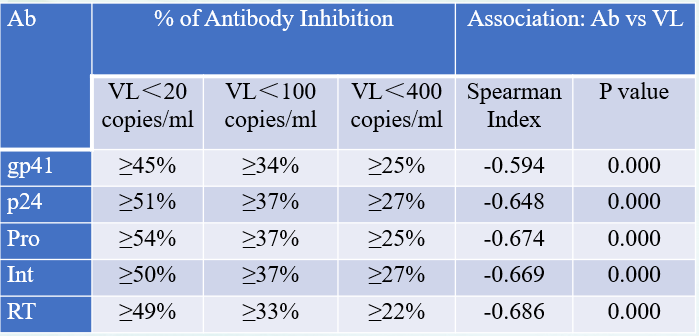
一般情况下,HIV 感染数周后,就有针对HIV蛋白的抗体产生,并且常被用于HIV感染的体外诊断。但抗病毒治疗也可抑制HIV体液免疫,也就是抗HIV抗体产生和滴度。有研究显示(表3),血清抗HIV抗体滴度变化反映了HIV-1复制水平,可以用于监测抗病毒治疗效果[13]。抗病毒治疗后,临床中也会出现抗HIV抗体血清学转阴或者无反应的情况,可能原因较多,比如抗HIV治疗抑制病毒复制,降低血液中病毒抗原量,无法刺激机体产生抗体。
表3. 抗HIV抗体滴度与病毒抑制的关系[13]
总的来说,抗病毒治疗可显著影响抗HIV抗体反应。对于急性期HIV感染者,早期抗病毒治疗可以抑制抗HIV抗体的应答、成熟,甚至出现抗体阴转或者无血清学反应,尤其是早期抗病毒治疗的婴幼儿[14]。慢性HIV感染者中抗HIV抗体对抗病毒治疗的反应不如急性感染者敏感。抗病毒治疗后,抗HIV滴度下降与病毒载量下降平行,可能用于监测抗病毒治疗效果和HIV-1储存库大小。
需要注意的是,抗病毒治疗后出现抗HIV抗体转阴并不代表HIV被清除,抗体滴度也可能随着病毒复制增强,或者说随着病毒反弹而改变。抗病毒治疗导致抗HIV抗体转阴或者无反应,可能导致误诊或漏诊,应该引起重视。早期抗病毒治疗可显著抑制HIV复制,改善免疫重建和预后。因此,区分HIV新近与慢性感染意义显而易见。目前已经有区分HIV新近与慢性感染的检测方法,包括现场快速检测方法[15],但还需要进一步完善。现阶段早期发现、早期诊断、早期治疗HIV-1感染者,问题仍然严重,需要推广HIV-1快速自检方法。
小 结
近年来,我国HIV-1基因型发生了明显变化,HIV-1基因型与病毒传播、扩散效率,疾病进展以及抗病毒治疗效果密切相关。感染CRF07_BC者,传播力增强,但免疫抑制和疾病进展较慢,抗病毒治疗效果更好。长期监测和发现HIV-1变异位点非常重要,可为监测HIV-1传播和抗病毒治疗效果提供靶点和方法,助力HIV感染的精准防控和改善患者预后。
参考文献:
1.Feng Y, et al. Scientific Reports 2016; 6:19279.
2.Chen X, et al. AIDS Res Hum Retroviruses 2016 Sep;32(9):851-9
3.Li X, et al. AIDS Res Hum Retro 2017.
4.Yan H, et al. Infect Genet Evol. 2021 Aug;92:104870.
5.Yan H, et al. Open Forum Infect Dis. 2020 May 6;7(5):ofaa154.
6.Cheng Z, et al. Microbiol Spectr. 2022;10(4):e0014622
7.Y Liang, et al. HIV Med. 2020 May;21(5):279-288.
8.HUANG S W, et al. PIoS one,2014,9(12):e114441.
9.Wu Y, et al. AIDS Res Hum Retroviruses. 2017;33(9):977-983
10.Cheng Z, et al. Microbiol Spectr 2022;10(4):e0014622
11.Li M, et al. Front Immunol 2022;13:850719
12.Han J, et al. Microbiol Spectr. 2022;10(5):e0254522
13.Liang et al. Journal of Clinical Virology 128 (2020) 104414.
14.Liang Y, et al. Front Immunol. 2022;13:844023
15.Zhao J, et al. Front Microbiol. 2022;13:1004960

专家简介
唐时幸教授
1981-1989在第一军医大学,获得医学学士和流行病学硕士学位,1990年到1993年在北京军事医学科学院攻读博士,1993-1995年在北京医科大学庄辉院士实验室从事博士后研究。1996年出国,先后在英国格拉斯哥大学病毒研究所、美国国家健康研究院(NIH)从事博士后研究;2002年起任美国NIH资深科学家。2004年起就职美国食品药品管理局(FDA),担任资深科学家, 负责传染病检测试剂与仪器的审批。2012年以“传染病检测方法和试剂研究领域世界知名专家”获选广东省创新领军人才 。2014年在南方医科大学担任教授、博士导师,从事事新发与再发传染性疾病分子流行病学、致病机制与新型检测技术研究。在Lancet、Clinical Infectious Diseases, Annals of Internal Medicine, Emerging Infectious Diseases, Journal of Virology、Journal of Infectious Diseases、Journal of AIDS等SCI期刊发表了100多篇论文。先后获得过军队科技进步二等奖(1996年)、美国NIH优秀研究员奖(2000年)、美国FDA优秀科学家奖(2007年)和美国FDA杰出分析科学奖(2011)。承担过传染病重大专项、科技部科技支撑项目、国家自然科学基金项目。先后研发了抗HCV抗体检测试剂盒(1992年)和H7N9流感病毒抗原快速检测试剂(2013年),填补了国内空白。2022年,基于CRISPR基因编辑技术检测新冠病毒变异株的方法获得中国发明专利。
往期回顾

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
访谈
专家访谈
其他肝病
发表评论
全部评论
