年会亮点丨李婕教授:新时期下,糖尿病和脂肪肝的共病、共管
—— 作者: 时间:2023-12-24
阅读数:
44
编者按
由中华医学会、中华医学会肝病学分会和感染病学分会联合主办、四川省医学会承办、四川大学华西医院协办的 “第二十一次全国病毒性肝炎及肝病学术会议暨 2023 年中华医学会肝病学分会年会、中华医学会感染病学分会年会”于2023年12月22-24日在四川省成都市隆重召开。本次会议是我国病毒性肝炎及肝病、以及感染性疾病领域国内水平最高的学术盛会,大会邀请国内外著名学者就目前病毒性肝炎和肝病学以及感染病学研究的最新进展及热点问题进行学术报告,并开展专题研讨,全方位展现学科领域的最新成就和发展趋势。会上,南京大学医学院附属鼓楼医院李婕教授分享了糖尿病和脂肪肝的共病与共管问题,现整理如下,以飨读者。
1
NAFLD的流行病学
非酒精性脂肪性肝病(nonalcoholic fatty liver disease,NAFLD)是目前世界范围内最常见的慢性肝病。李婕教授团队研究发现NAFLD在亚洲成年人的患病率为 29.63%,且呈逐年上升趋势。男性(37.11%)、高龄(32.23%)、合并肥胖(52.3%)、糖尿病(Type 2 Diabetes Mellitus,T2DM)(52.4%)是NAFLD发病的高危因素[1]。另一项荟萃分析研究发现,NAFLD在中国大陆一般人群中的患病率为29.88%,其中,男性的患病率为34.75%,绝经后女性为34.52%,50-59岁人群为29.14%。合并T2DM和肥胖的患者中,NAFLD的患病率分别高达51.83%和66.21%。按地域划分,北方患病率最高,西南地区最低[2]。
NAFLD是一种多系统受累的代谢性疾病,是与胰岛素抵抗和代谢性炎症相关的全身多系统疾病的重要组分,与肝外众多慢病相互影响引发复杂的并发症。NAFLD患者主要死亡原因依次为心血管疾病、肝外恶性肿瘤、T2DM以及慢性肾病和肝脏相关并发症[3]。
2
NAFLD的更名突出了代谢异常的主导地位
随着全球肥胖和糖尿病的流行,排他性诊断的疾病术语(NAFLD)的局限性日渐明显。为此,2020年,以澳大利亚和美国学者为首的NAFLD专家建议将NAFLD和NASH(nonalcoholic steatohepatitis)分别更名为代谢相关脂肪性肝病(MAFLD,metabolic dysfunction-associated fatty liver disease)和代谢相关脂肪性肝炎(MASH,metabolic dysfunction-associated steatohepatitis)。
MAFLD的新诊断标准基于脂肪变性的证据(肝组织学、非侵入性生物标志物或影像学)以及以下三种情况中的一种:①超重或肥胖;②T2DM;③≥2种代谢功能障碍的表现。这是基于代谢功能障碍这一关键驱动因素的“肯定性”诊断标准,无需考虑饮酒或其他伴随的肝脏疾病。大量循证研究显示[4-6],年轻时的超重和肥胖使男性随后严重肝病的发病风险增加1.49倍和2.17倍;肥胖合并T2DM比肥胖无T2DM男性的发生严重肝病风险更高,分别增加3.28倍和1.72倍;与没有代谢影响的患者相比,有高血压和血脂异常的脂肪肝患者进展为肝硬化/HCC的风险高1.8倍;有T2DM、肥胖、血脂异常和高血压的则高2.6倍。因此,T2DM、肥胖、血脂异常以及高血压等代谢功能障碍不仅是脂肪性肝病的重要病因,也是不良预后的危险因素。
然而,MAFLD的新定义受到AASLD和NASH新药研发企业的反对。AASLD联合欧洲肝病学会成立NAFLD更名专家顾问团,在2023年6月24日正式对外发布“脂肪性肝病新命名的多学会的德尔菲共识”,建议将NAFLD更名为MASLD (metabolic dysfunction-associated steatotic liver disease),并肯定NASH的重要性,建议将其更名为代谢相关脂肪性肝炎(MASH)。MASLD包括患有肝脂肪变性且至少具有五种心脏代谢危险因素之一的患者。那些没有代谢危险因素和可能导致脂肪肝因素的人被称为隐源性脂肪性肝病(cryptogenic SLD)。在MASLD之外,选择一个名为MetALD的新类别来描述每周饮酒量较大的MASLD患者(女性≥140g乙醇/周和男性≥210g乙醇/周)[7]。
3
脂肪肝与糖尿病——共病
脂肪肝与糖尿病存在共同的病理生理学机制。胰岛素抵抗是糖尿病的始发因素,同时也是脂肪肝的核心发病机制。它导致外周葡萄糖摄取能力下降、脂类分解增加,血清中游离脂肪酸(FFA)浓度迅速升高,肝脏摄取的FFA随之增加,同时,多种调节因素改变,包括肠道营养衍生的信号、脂肪因子、促炎细胞因子等,从而导致NAFLD的发生[8]。
脂肪肝和糖尿病互为因果。一项Meta分析[9]纳入33个研究,共 501022人(30.08%为NAFLD),随访中位数为5年,其中27953人发生T2DM。与无NAFLD者相比,NAFLD患者发生T2DM的风险更高(HR=2.19.95% CI:1.93-2.48),NAFLD越严重越容易患T2DM(HR=2.69.95%CI:2.08-3.49)。Younossi等开展的荟萃分析[10]纳入86个研究,共 8515431人(图1),NAFLD/NASH患者中T2DM患病率分别为22.51% (95%CI: 17.92-27.89) 和43.63% (95% CI: 30.28-57.98)。成人T2DM患者中NAFLD/NASH流行病学的相关研究表明[11],T2DM患者中NAFLD和NASH患病率分别为65.04%和31.55%,T2DM合并NAFLD患者中显著纤维化(F2-F4) 35.54%,进展期肝纤维化(F3-F4)14.95%。
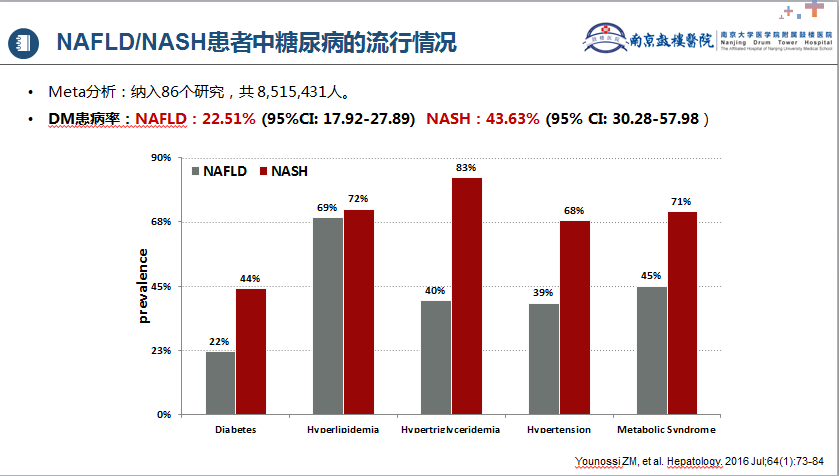
图1. NAFLD/NASH患者中糖尿病的流行情况
肝酶正常的糖尿病患者仍可能存在严重的肝纤维化。一项法国的研究[12]纳入了561例初级保健或内分泌门诊就诊且转氨酶正常的T2DM患者,并进行了受控衰减(controlled attenuation parameter,CAP)和振动控制瞬时弹性成像 (vibration controlled transient elastography,VCTE)检测。结果显示,70%的患者合并肝脂肪变,21%合并肝纤维化;而仅有28%的严重肝纤维化患者有肝酶的异常。
糖尿病增加NAFLD患者发生肝硬化、HCC风险,增加NAFLD患者发生肿瘤的风险。美国一项回顾性研究[13]纳入2004.1.1-2008.12.31期间130家医院的202319名NAFLD患者,随访至2018.12.31。在3-year landmark分析中,473名患者进展为HCC,发病率为0.28/1000人年(PY)(95% CI,0.26,0.31)。合并T2DM的NAFLD患者有较高的HCC(HR: 2.65)、HCC/肝硬化(HR: 2.46)发生风险。瑞典一项研究[14]纳入全国在1966-2016年期间经活检证实为NAFLD的8,892例患者,并与年龄、性别、地域等因素相匹配的39,907例对照组进行比对分析。中位随访时间为13.8年,1,691例NAFLD患者发生肿瘤。与对照组相比,NAFLD患者的总体肿瘤发病率增加1.27倍(10.9 vs. 13.8 per 1,000 person-years)主要为HCC(HR:17.08),所以合并糖尿病,增加NAFLD肝硬化患者肿瘤发生风险。
糖尿病、代谢因素会增加MAFLD患者的死亡率。李婕教授团队最新的一项研究[15],纳入4559名MAFLD(30.8%)患者,其中T2DM患者占25.5%。研究发现,合并T2DM有较高的全因死亡风险(HR: 1.427)和心血管相关死亡率(HR: 1.458)。另一项未发表的研究纳入2258名MASLD患者,在<65岁人群中,随着合并的代谢因素的增加,MASLD患者全因死亡风险明显增加(图2)。
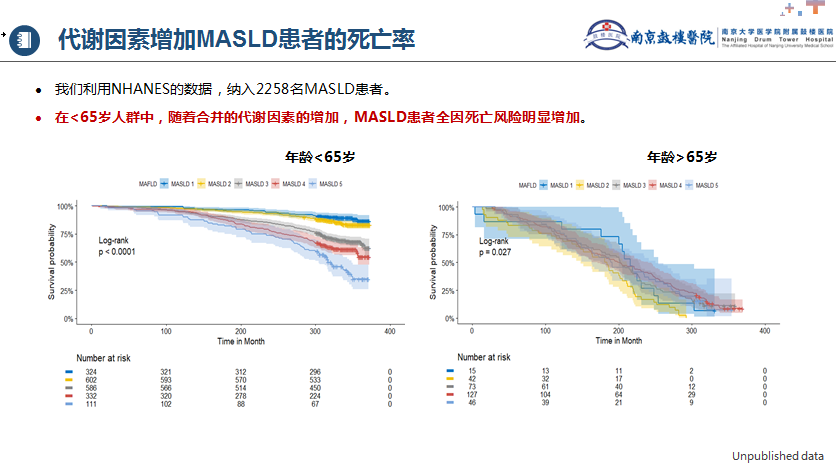
图2. 代谢因素增加MASLD患者的死亡率
合并糖尿病增加慢性乙型肝炎(CHB)+脂肪肝(FL)患者疾病进展风险。李婕教授团队[16]开展了一项2004-2020年期间来自中国4个省份(江苏、浙江、福建、河南)、8家医疗中心接受肝活检的869名合并FL的初治CHB患者的研究。研究发现,在CHB合并NAFLD群体中,与不伴有T2DM患者相比,合并T2DM的患者出现显著肝脏炎症和显著纤维化的风险更高,且与年龄、性别、肝脏脂肪变性、其他代谢因素(如BMI)和病毒学因素无关。同时,利用CHB合并NAFLD患者的多中心肝活检队列,建立了一种基于糖尿病预测显著肝纤维化的无创新模型PPDHG。
PPDHG(PLT/PT/Diabetes/HBeAg/GLB):-8.773 - 0.008 × PLT + 0.569 × PT + 1.697 × diabetes(yes = 1, no = 0)+ 0.611 × HBeAg(positive=1, negative=0)+ 0.063 × GLB[17]。团队另一项最新研究[18]利用NHANES的数据,纳入2803名T2DM患者,其中超声诊断为MAFLD患者有1903(67.9%)例。结果表明FIB4≥1.3且无严重脂肪变的T2DM患者有较高的全因死亡风险(HR: 2.115)。
4
脂肪肝与糖尿病——共管
MAFLD的诊疗围绕“代谢障碍”,MAFLD比NAFLD更易识别显著肝纤维化和具有疾病进展高风险的患者。MAFLD患者的肝脏硬度值高于NAFLD患者。MAFLD比NAFLD更易识别心血管疾病风险恶化和慢性肾脏疾病患者。MAFLD患者的阻塞性睡眠暂停的患病率和严重程度更高[19]。APASL2020年MAFLD诊断和管理临床实践指南指出[20],对于超重/肥胖、2型糖尿病和代谢综合征等高危人群,应考虑超声筛查MAFLD。MAFLD患者应评估代谢综合征的其他组分,并进行相应治疗。MAFLD患者应评估心血管疾病风险,必要时转诊至心脏病学专家。应对血脂异常、高血压和糖尿病进行相应的诊断和治疗,以降低罹患心血管疾病和肾脏疾病的风险。MAFLD且经常与其他肝脏疾病共存,其治疗和伴随疾病的治疗应按照每种疾病的建议。该指南强调了高危人群MAFLD筛查、肝内外疾病管理的重要性。
AASLD 2023年NAFLD患者临床评估和管理意见指出[21-22],T2DM增加NAFLD患者NASH和进展期肝纤维化发病风险,T2DM患者必须筛查进展期肝纤维化。NASH相关进展期肝纤维化患者血清转氨酶水平通常在参考值范围,不能仅仅根据转氨酶正常而排除进展期NASH的可能性。FIB-4≥1.3的NAFLD患者可以通过肝脏瞬时弹性成像、磁共振弹性成像或增强肝纤维化指数排除进展期肝纤维化。
我国相关领域的专家也逐步形成“肝硬化合并糖尿病患者血糖管理”、“中国成人2型糖尿病合并NAFLD的管理”等专家共识。在糖尿病合并NAFLD的治疗管理主要聚焦于三个方面,首先改善代谢异常,改善如体重异常、T2D/高血糖、高血压及血脂紊乱等代谢综合征。其次针对肝脏治疗NASH和肝纤维化,降低肝脏硬度和肝脂肪含量,改善相关生物标记物,使得肝纤维化改善及NASH缓解。最后改善主要的肝脏相关结局事件,如进展至肝硬化、出现肝硬化失代偿事件、肝移植、肝细胞癌或肝病相关死亡/全因死亡。改善主要心血管相关结局事件:如心血管死亡,卒中,心梗。“中国成人2型糖尿病合并NAFLD的管理专家共识”建议成立多学科团队,以长期有效地管理T2DM合并NAFLD患者。对糖尿病-脂肪肝进行全科-专科共同管理,以病人为中心,通过对高危人群筛查以及患者的分级诊疗,进行多学科全流程的管理。
5
全-专诊模式探索
基于以上循证及专家共识,南京大学医学院附属鼓楼医院以三级医院+基层医疗机构的模式,开启脂肪肝患者的三级医院与基层医院联动模式。探索脂肪肝筛查、诊治、管理的全流程临床路径,以提高基层医生对于脂肪肝的诊疗水平,建立基层脂肪肝诊疗标准化体系,强化基层医生对脂肪肝患者筛查及管理意识,提高患者治疗率。医院深入社区,建立社区脂肪肝门诊,对高危人群进行社区筛查和管理,筛选出需要治疗的患者转诊到综合医院的脂肪性肝病中心及对应疾病专科,通过相关检测进一步评估并制定合适的治疗方案。另外,加强脂肪肝全专科规范化诊疗培训基地项目建设,不断提升社区医院规范化管理的能力。今年12月份首期“脂肪肝全专科规范化诊疗培训班”如期举办,李婕教授指明本次培训班旨在建立脂肪性肝病的全专科诊疗体系,加强等级医院与社区医院的互动,尤其是在脂肪肝及相关代谢病方面,提升并规范化社区医院的诊疗。
随着肥胖、糖尿病等代谢性疾病患病率的增加,MAFLD呈逐年增长趋势。由于缺乏大样本的流行病学研究及诊断方法的差异,糖尿病人群中MAFLD的确切患病率难以确定。对于超重/肥胖、2型糖尿病和代谢综合征等高危人群,应考虑超声筛查MAFLD。由于尚无经批准的治疗MAFLD的药物,目前的管理侧重于生活方式和饮食习惯的调整。同时,MAFLD患者应评估代谢综合征的其他组分,并进行相应治疗。建议成立全专科协作的多学科团队,以长期有效地管理T2DM合并NAFLD患者。
参考文献:
[1] Jie Li / Mindie H, et al. The Lancet Gastroenterology & Hepatology. 2019 May.
[2] Yuankai Wu, Qi Zheng, et al. Hepatol Int. 2020 Mar 4.
[3] Christopher D Byrne, Giovanni Targher. Journal of Hepatology 2015 Apr.
[4] Eslam M, et al. J Hepatol. 2020 Jul;73(1): 202-209.
[5] Eslam M, et al. Hepatol Int. 2020 Dec 14(6):889-919.
[6] Gallego-Durán R,et al. Front Immunol. 2021 Nov. 24.
[7] Rinella ME et al. J Hepatol. 2023 Jun 20:S0168-8278(23).
[8] Targher G, et al. Nat Rev Gastroenterol Hepatol. 2021 Sep 18(9):599-612.
[9] Mantovani A, et al. Gut. 2021 May;70(5):962-969.
[10] Younossi ZM, et al. Hepatology. 2016 Jul;64(1):73-84.
[11] En Li Cho E et al. Gut. 2023 Jul 25:gutjnl-2023-330110.
[12] Lomonaco et al. Diabetes Care. 2021 Feb;44(2):399-406.
[13] Cholankeril G, et al. J Hepatol. 2022 Nov 16.
[14] Simon TG, et al. Hepatology.2021 Nov;74(5):2410-2423.
[15] Zhu Y / Jie Li (Corresponding), et al. J Pers Med. 2023 Mar 20;13(3):554.
[16] Li J, et al. Hepatol Int (2023) 17:S104. APASL 2022 Oral.
[17] Li J, et al. J Viral Hepat. 2023 Apr;30(4):287-296
[18] Jie Li (Corresponding), et al. Hepatology International. 2023
[19] Jie Li (Corresponding), et al. Infectious Microbes & Diseases. 2022 Jun.
[20] Eslam M, et al. Hepatol Int. 2020 Dec;14(6):889-919.
[21] 倪文婧, 李婕, 范建高. 临床肝胆病杂志. 2023.
[22] Rinella E, et al. Hepatology 2023 May 1.

专家简介
李婕教授
南京大学医学院附属鼓楼医院感染性疾病科 行政主任
南京大学病毒与感染病研究所 常务副所长
主任医师、研究员、南京大学教授、博士生导师、江苏特聘医学专家
美国斯坦福大学、中国香港大学访问学者
江苏省医师协会感染医师分会副会长
中国研究型医院学会肝病专业委员会常委、脂肪肝和酒精肝学组副组长
中华医学会肝病学分会青年委员、脂肪肝和酒精性肝病学组委员
主要研究方向为脂肪性肝病、病毒性肝炎的发病机制及临床诊疗。以第一作者/通讯作者在Lancet Gastroenterology & Hepatology、American Journal of Gastroenterology、Clinical Gastroenterology Hepatology、Alimentary Pharmacology & Therapeutics等SCI杂志发表论文50余篇,其中3篇入选ESI高被引。承担国家自然科学基金3项,以及教育部基金、“十三五”重大专项子课题、中国博士后基金、省自然科学基金(面上、重点)、省重点研发计划等课题17项。获省科技进步奖省医学科技奖、省高校科技进步奖、华夏医学科技奖各一项。

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
快讯
现场快报
脂肪肝
发表评论
全部评论
