当前位置:APASL-亚太肝脏研究协会年会 » 正文
纪泛扑教授团队:肝细胞癌靶免治疗、HCV清除患者长期预后等多项成果入选口头报告丨APASL 2024
—— 作者: 时间:2024-03-29 09:11:59 阅读数:
43
编者按:樱花烂漫,春日正美。3月29日(大会第三日),日本京都国际会议中心大咖云集,第33届亚太肝脏研究学会年会(APASL 2024)进入到会议高潮。“肝细胞癌(HCC)”是今日会场的关键词,我国西安交通大学第二附属医院感染科纪泛扑教授团队亦在会上介绍了两篇HCC领域最新研究,聚焦在老年晚期HCC靶免治疗,以及HCC死亡趋势和2040年死亡率预测。此外,团队另有2项丙型肝炎领域研究成果被大会接收为口头报告,在此表示热烈的祝贺!《国际肝病》特别邀请到纪泛扑教授团队介绍以上最新科研成果,并点评HCC免疫治疗和慢性丙型肝炎病毒清除后长期预后的重要进展。

邱思铠代表团队在APASL 2024作报告
研究一
卡瑞利珠单抗联合分子靶向药治疗老年晚期肝细胞癌患者的疗效和安全性
O-0682: Effectiveness and tolerability of camrelizumab therapy for the elderly patients with unresectable or advanced HCC
第一作者:成龙,张悦
通讯作者:纪泛扑,郭江,高宁

研究背景
PD-1抑制剂目前已广泛应用于治疗不可切除/晚期HCC(Hepatocellular carcinoma,HCC)。老年HCC患者作为HCC的特殊人群,PD-1抑制剂对这类人群的疗效和安全性在真实世界研究中仍不确切。为了探究卡瑞利珠单抗联合分子靶向药治疗老年不可切除/晚期肝细胞癌患者的疗效和安全性,我们进行了这项多中心回顾性研究。
研究方法
我们的研究纳入了99例在2019年1月1日至2021年3月31日接受卡瑞利珠单抗治疗的不可切除/晚期HCC患者。其中84例患者接受了卡瑞利珠单抗联合靶向治疗,根据患者年龄分为老年组(年龄≥65岁,n=27)及非老年组(年龄<65岁,n=72),评估两组患者总生存期(OS)、无进展生存期(PFS)、客观缓解率(ORR)、疾病控制率(DCR)和免疫相关不良反应(Immune-related adverse events,irAEs)发生情况。
研究结果
本研究中位随访时间为12.1个月(95%CI:9.9~14.0)在老年组中,12个月的OS率、ORR和DCR分别为 67.8%、44.4% 和74.1%,中位PFS为6.4(95%CI:3.0~12.4)个月,与非老年组患者均无差别。老年组的中位OS尚未达到,非老年组的中位OS则为18.9(95%CI:8.9~20.5)个月。多因素Cox回归分析显示基线大血管浸润(MVI)是6个月PFS(HR 2.60,95%CI:1.14~5.96,P=0.024)和DCR(HR 3.96,95%CI:1.67~9.39,P=0.002)的独立危险因素,而年龄、性别、乙型肝炎病毒病因、出现肝外转移、Child-Pugh B级和AFP>400 ng/ml则与6个月PFS和DCR无关。老年组患者中任何级别的irAEs和3/4级irAEs发生率分别为51.9%和25.9%,与非老年组患者均无差别,老年组最常见的3级以上不良反应为肝毒性(11.1%)和原发性肾上腺皮质功能减退(11.1%),两组最常见的irAEs为免疫相关性血小板减少(28.3%)。
表1. 可评估的放射学反应和生存期
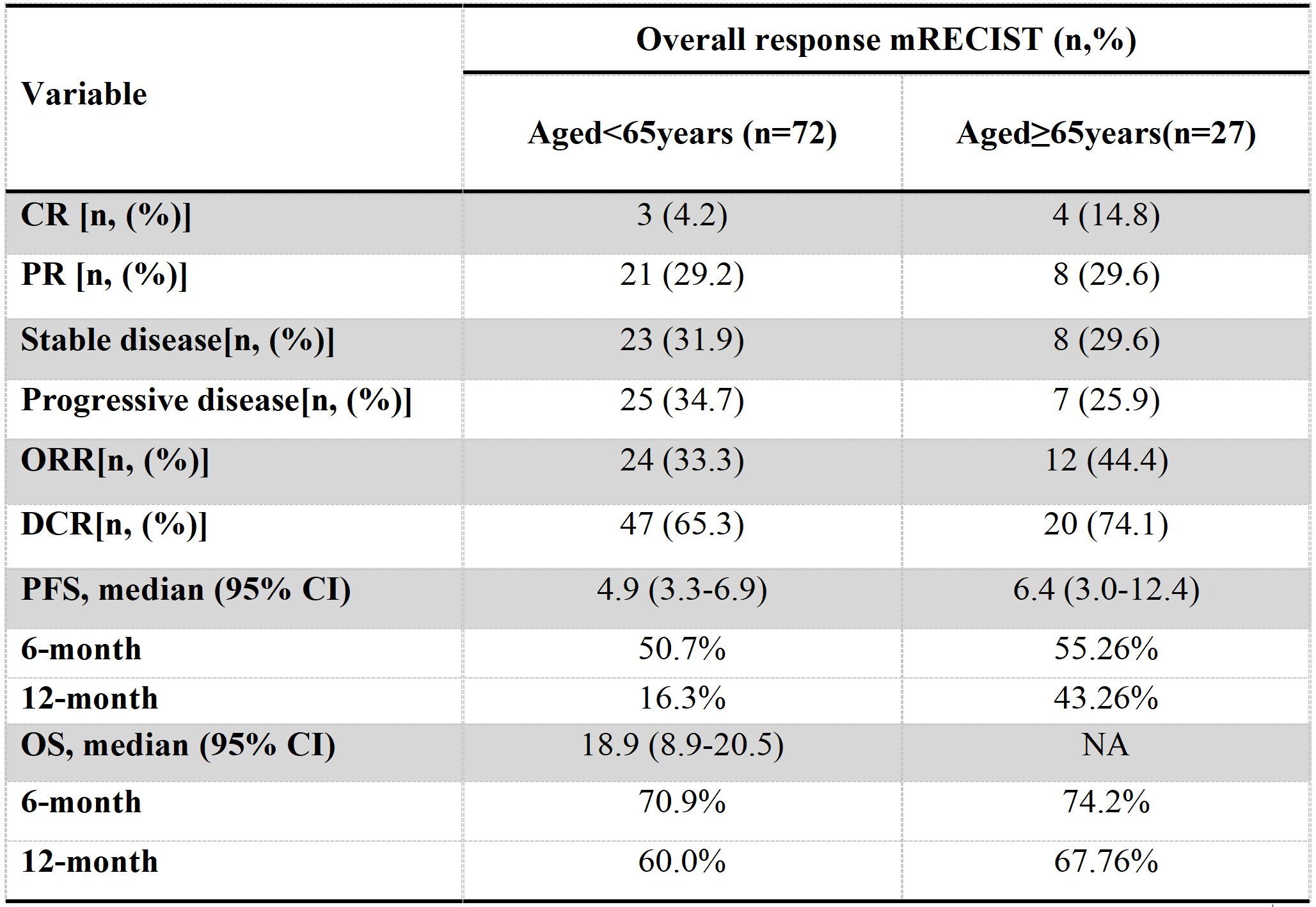
CR: complete response; PR: partial response; ORR: objective response rate; DCR: disease control rate; PFS: progression-free survival; OS: overall survival; CI: confidence interval; ORR: CR+PR; DCR: CR+PR+Stable disease
研究结论
卡瑞利珠单抗联合分子靶向药物治疗不可切除/晚期老年HCC患者的疗效和安全性与65岁以下患者相当。MVI与免疫治疗应答不佳和不良预后相关。
研究二
美国肝细胞癌的死亡趋势和2040年预测死亡率:一项基于人群的研究
O-0613: Trends and forecast mortality of hepatocellular carcinoma by 2040 in the United States: A population-based study.
第一作者:邱思铠,蔡江滢,杨展鹏
通讯作者:纪泛扑,Mindie H. Nguyen

研究背景
肝癌的全球疾病负担较大,在2020年已经成为了全球癌症死亡的第三大病因,并且对于全球和美国而言,总体发病率和死亡率还在不断增加。先前研究表明,HBV和HCV相关肝细胞癌(HCC)的死亡率正逐年下降,而酒精性肝病(ALD)和非酒精性脂肪肝(NAFLD)相关HCC的死亡率则在持续上升。基于此,我们的研究描述2006~2022年HCC相关死亡的变化趋势,并建立预测模型,对美国不同人群2023到2040年的HCC相关死亡率进行预测,探究未来美国的HCC死亡情况的变化以及不同人群之间HCC死亡情况的差异。
研究方法
使用CDC WONDER网站访问NVSS数据库获取2006至2022年美国肝细胞癌死亡数据,并使用Joinpoint回归分析计算APC来评估死亡趋势。基于2006年至2022年的死亡数据,我们使用Prophet和Auto-ARIMA模型进行建模,预测2023年至2040年的死亡率,并根据病因、年龄、性别和种族/族裔进行了分层分析。
研究结果
2006年至2022年间的188,280例HCC相关死亡,从2006年(3.65/10万)到2022年(5.03/10万),HCC相关死亡的年龄标准化死亡率(ASMR,每10万人)逐渐增加。时间趋势分析显示总体增长速度放缓,APC从4.1%(2006~2009年)下降至1.8%(2009-2022年),预计到2040年HCC相关死亡的总体ASMR仍会保持增长趋势。男性与女性的ASMR均呈现上升趋势,预测2023-2040仍会持续上升。其中女性的增加趋势尤为明显,其APC从2.2%(2006~2019年)上升至4.7%(2019~2022年)。我们预测,其ASMR与2022年的2.33相比,到2040年将增加至3.33。
25~64岁年龄组,HCC相关死亡的ASMR从2006~2011年的上升趋势转变为2011~2022年的下降趋势,并在2017后显著下降(APC为-6.2%)。预测结果显示,在2023~2040年,该年龄组的ASMR将趋于稳定。而≥65岁年龄组,其ASMR在整个研究期间持续上升,尤其是在2014年后上升趋势最为显著,APC为7.2%(2014~2017年)、5.0%(2017~2022年)。预计到2040年,其ASMR将上升至32.81。按照种族划分,HCC相关的总体ASMR在美国印第安人/阿拉斯加原住民族呈现快速上升趋势,而亚裔人群则持续降低。
从病因上看,HCV相关的死亡在2015年达到峰值,之后迅速下降,预计将从2023年的0.69下降至2034年的0.03。对于HBV也是先上升后下降的趋势,但其预测的ASMR在2023到2040年更趋于稳定,到2040年稳定在0.08左右。与之相反,ALD和NAFLD相关HCC死亡的比例在2006年至2022年间急剧上升。但是ALD相关HCC死亡人数的增长速度自2008年起有所减缓,而NAFLD则是稳定上升。ALD相关HCC死亡预计将在2026年成为HCC死亡的最主要原因。到2040年,ALD的ASMR将增长至0.86,同时NAFLD的也将增至0.26。
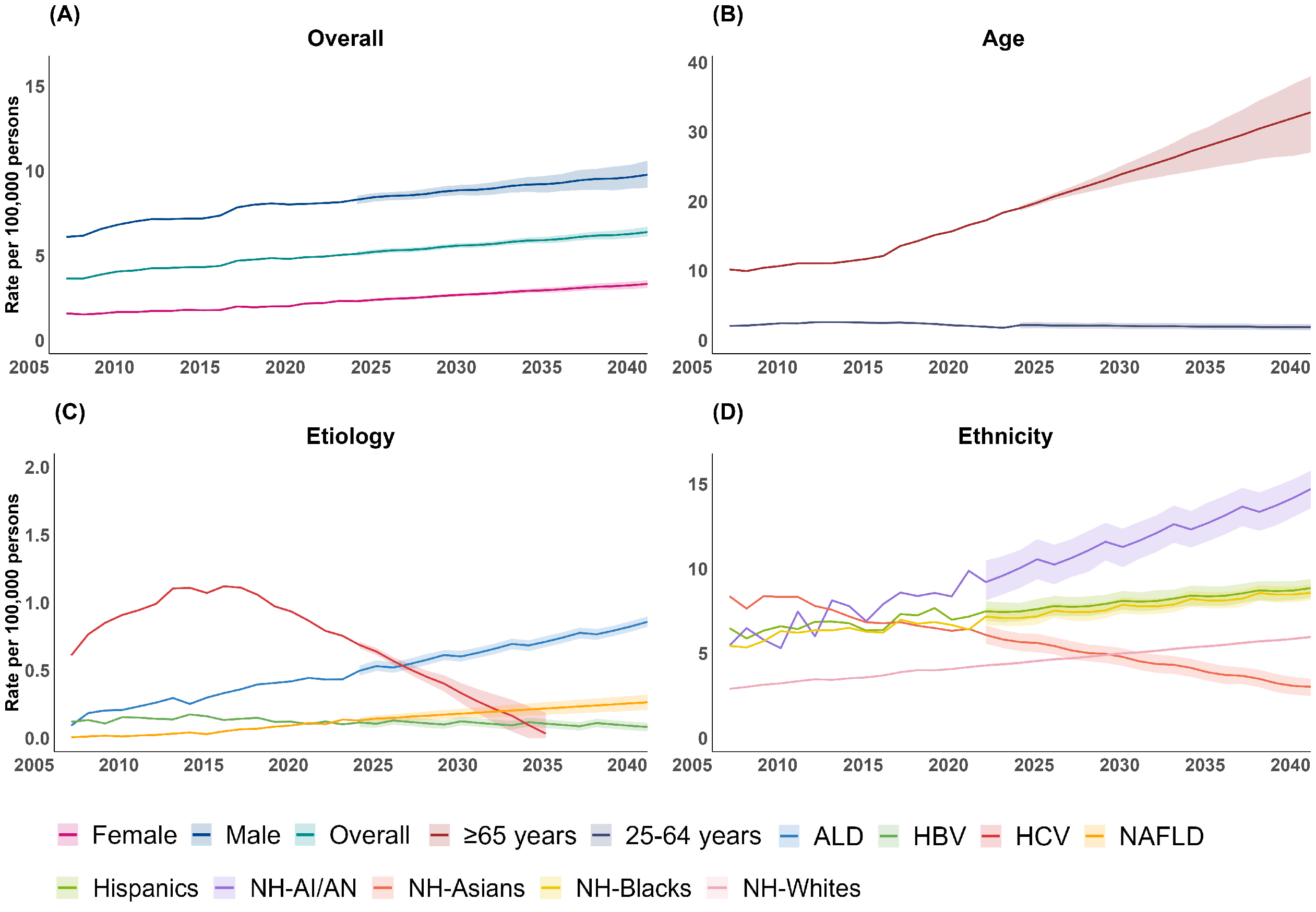
图1. 2006-2040 年美国性别、年龄、病因和种族亚组的 HCC 年龄标准化死亡率
研究结论
2006年至2040年美国ALD和NAFLD相关HCC的ASMR以惊人的速度增加,其中ALD相关HCC上升最为迅速,可能在将来成为HCC相关死亡最主要病因,并且女性和老年人群肝癌死亡出现了显著增长,需要更多的关注和防治。
研究三
成功治疗的丙型肝炎患者的死亡率:一项真实世界的跨国队列研究
O-0216: Mortality rates among patients successfully treated for hepatitis C: A real world multinational cohort study
第一作者:纪泛扑
通讯作者:Mindie H. Nguyen

研究背景
DAA治疗改变了慢性丙型肝炎感染的治疗方法,超过 95% 的患者治疗成功。成功治疗的患者比未经治疗的患者表现出更好的临床结局(例如肝病进展、HCC风险、肝外疾病)。DAA 治疗清除HCV,获得 SVR 可降低死亡风险,但与 DAA 相关 SVR 后死亡相关的危险因素的数据很少。本研究目的是量化死亡率和相关风险因素以填补这一空白。
研究方法
来自西太平洋地区、北美和欧洲共 39 个 REAL-C 临床中心的 11,451 名 SVR 患者被纳入真实世界跨国队列。研究纳入任何基因型 CHC 患者接受 DAA 治疗并达到 SVR12,基线合并HBV/HIV重叠感染,既往HCC病史或治疗结束后6月内发生HCC均排除研究之外。研究根据患者基线肝病严重程度分位三组:非肝硬化(第 1 组)、代偿期肝硬化(第 2 组)、失代偿期肝硬化(第 3 组)。主要结局是 DAA-SVR12 后的死亡率。
研究结果
分析中总共纳入了 10 034 名成功治疗 HCV 的患者,其中包括 5611 名非肝硬化患者、4153 名代偿期肝硬化患者和 270 名失代偿期肝硬化患者。在 SVR 后平均 4.7 年的随访期间,分析全因死亡率以及肝脏和非肝脏相关死亡率,总共有 491 例(4.9%)死亡。总体人群全因死亡率为每 1000人年 10.4人,无肝硬化、代偿期肝硬化和失代偿期肝硬化患者每 1000人年全因死亡率分别为 6.2人、13.1人和 60.0人。整体队列的3年和5年总生存率为97.8(97.6~98.3)和95.1(94.5~95.6)。其中,失代偿期肝硬化患者的 3 年(87.5%)和5年 (73.9%)生存率最低。在多变量分析中,年龄较大(>65岁:3.25倍)、男性(1.5倍)、纤维化严重程度(失代偿/代偿期肝硬化为7.6/1.8倍)、基线 DM(1.53倍)、非亚裔(2.12 倍)与较高的死亡率显着相关。按肝病严重程度划分的 DAA-SVR 患者的肝脏和非肝脏死亡率结果如图1所示。对于 DAA-SVR 的非肝硬化、代偿期和失代偿期肝硬化患者,8 年估计累积死亡率分别为 6.0%、11.6% 和 47.7%(图2)。

图2. 按肝病严重程度划分的 DAA-SVR 患者的肝脏和非肝脏死亡率结果

图3. 按肝病严重程度划分的 8 年估计累积死亡率发生率(非 LC、Comp LC 和 Decomp-LC)
研究结论
DAA治疗获得SVR 的患者面临不同的死亡风险,其中死亡风险与 DAA 治疗前肝病严重程度密切相关。与 DAA-SVR 后死亡率相关的基线因素包括高龄、男性、肝硬化、非亚裔和糖尿病。非肝脏相关死亡率(5.2-8.2/1000患者年)是无肝硬化和代偿期肝硬化患者的主要原因,而肝脏相关死亡率(33.8/1000患者年)是失代偿期肝硬化患者的主要原因。这些发现强调了在成功治疗 HCV 后对高危患者进行个体化风险评估和持续监测的必要性,以最大限度地发挥 HCV 治愈的效果。
研究四
DAA治疗基因型1-6型HCV患者的真实世界疗效和耐受性的国际多中心研究
O-0215: Real-world effectiveness and tolerability of interferon-free DAA for 15,849 hepatitis C patients with genotypes 1 to 6: A multinational cohort study
第一作者:纪泛扑 Sally Tran
通讯作者:Mindie H. Nguyen

研究背景
HCV基因型分布及DAAs治疗模式均存在地理上的差异,为实现WHO拟定的2030年全球消除HCV的目标,本REAL-C研究探讨常规临床实践中接受DAAs治疗的慢性丙型肝炎(CHC)患者应答情况和影响获得持续病毒性学应答(SVR12)的因素,以便为医疗实践和公共卫生政策提供参考信息及建议。
研究方法
2014 年 7 月 1 日至 2021 年 7 月 1 日期间在亚太、北美和欧洲 39个临床中心建立真实世界队列研究,在排除实体器官移植、应用免疫抑制剂及预后生存期小于<12月的患者后,最终纳入15 849 例使用无干扰素的DAA治疗的成年 CHC 患者的数据进行分析。研究旨在评估DAA治疗的SVR12率和耐受性,以及影响应答的因素,尤其聚焦于基因3型和6型。
研究结果
15849 例患者平均年龄62±13岁,大部分为亚洲人(91.1%),GT1是最常见的基因型(64.6%),其次是GT2(23%)、GT3(7.2%)、GT6(2.8%)、GT4。24.9%为经治患者(干扰素经治 20.7%,DAA 经治 4.3%),34.8%患者肝硬化,8.9%患者合并 HCC,3.0%和 1.7%患者分别重叠感染 HBV 和 HIV。
此外,常见的合并症包括高血压(37.6%)、糖尿病、血脂异常和心血管疾病。总体人群SVR12率为96.9%;绝大部分亚组(包括高龄、肾功不全、经治、肝硬化和 HCC)的患者均超90%。依据基因型、肝硬化和既往治疗史分层,有既往治疗史合并肝硬化患者的SVR12最低(93.2%),特别是GT3/6,但仍可达91%左右;但无论肝硬化状态如何,初治患者的SVR12均≥97.5%。
多因素分析显示年龄>60、经治、肝硬化、活动性HCC及GT3/4与治疗失败独立相关;而亚洲人群是获得SVR12 的重要预测因素。总体不良反应发生率较低,常见的不良反应包括疲劳、瘙痒、失眠、头痛和恶心等非特异性症状。严重不良反应罕见(0.6%),2.2%患者出现早期中断治疗,未出现DAAs治疗相关的死亡。

图4. 按GTs、肝纤维化分期和既往治疗分层的CHC患者的SVR12率
研究结论
尽管存在肝硬化、HCC、经治、GT3/6及非亚洲人等不利因素患者比例高,但总体治愈率仍高达96.9%,且耐受性良好。针对特殊人群(例如:活动性 HCC 患者)的 SVR12 率略低,因此需要额外的指南建议,以增加DAAs的使用,以满足WHO提出的2030年全球消除HCV的倡议。

纪泛扑 教授
医学博士,主任医师,博士生和博士后导师,环境与疾病相关基因教育部重点实验室副主任,陕西省感染性疾病临床医学研究中心副主任,陕西省“三秦英才特殊支持计划”创新团队负责人,陕西省中青年科技创新领军人才,陕西青年科技奖获得者,中国研究型医院学会肝病专委会青年副主委,陕西省中西医结合学会传染病分会副主任委员,西安市感染症学会常委。JCTH、WJH、中国肝脏病杂志编委,PH&C、iLiver青委。主持国科金、国际合作项目3项,省校级项目12余项;以PI牵头国际/全国/西北地区多中心临床研究10项;获陕西省科技进步一等奖、西安交大医疗技术一等奖各1项;第一/通信在JAMA Oncol、J Hepatol、Lancet Oncol、Gut、Hepatology、Chem Eng J、eClinicalMedicine、JIM、JAMA NO、AJG、CID、JMV等发表论文60余篇。
(来源:《国际肝病》编辑部)

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
标签:
访谈
现场快报
肝癌
发表评论
全部评论