肝硬化门脉高压(PHT)是代偿期慢性肝病(cACLD)患者出现并发症的主要原因,其中临床显著门脉高压(CSPH)与静脉曲张、失代偿、肝细胞癌及高死亡率密切相关。非选择性β受体阻滞剂(NS
非侵入性测试(NITs),如肝脏硬度测量(LSM)、脾脏硬度测量(SSM)及血小板计数(PLT),已被验证可用于CSPH的诊断及预测失代偿。然而,这些方法在单独使用时存在不足,尤其是在LSM值介于15~25 kPa之间的“灰色区域”患者,其诊断结果不确定,需要进一步检查。鉴于现有方法的局限性,一项近日发表于Journal of Hepatology的研究利用PREDESCI试验筛选的cACLD患者队列,评估并验证了一种新的基于NITs(LSM、SSM、PLT)结合内镜检查的算法,以提高CSPH的诊断准确性,并为临床实践和未来的试验设计提供新的工具。研究者表示,通过这种方法,期望能够更准确地识别需要NS
重要图表摘要
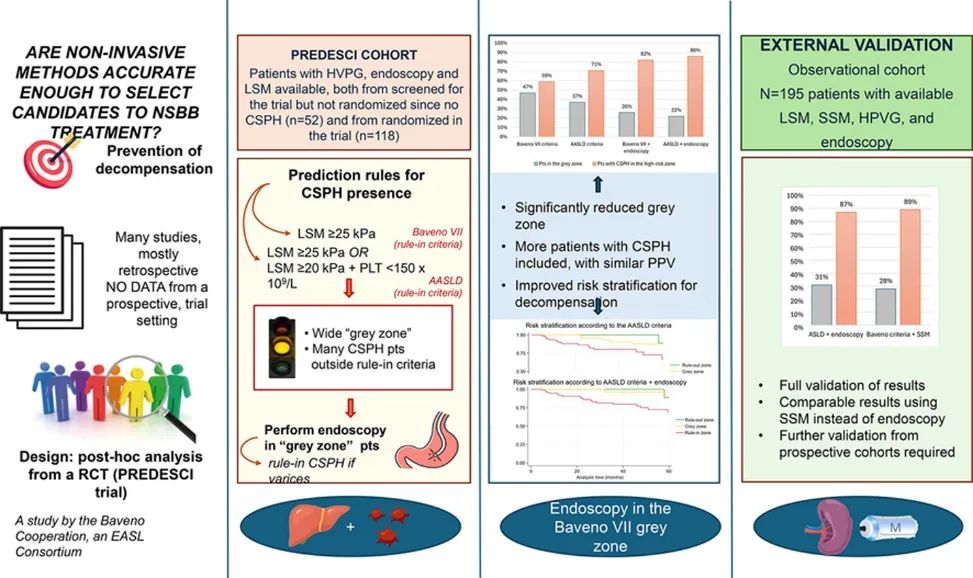
该研究纳入了在PREDESCI试验中接受筛查的代偿期肝硬化患者,这些患者均进行了肝脏弹性成像检查。研究者评估了基于肝脏硬度测量(LSM)和血小板计数(PLT)的模型的性能,然后开发了一种对NITs结果不确定(即“灰色区域”)的患者进行内窥镜检查的算法,并在195名患者的独立队列中进行了验证。
Baveno ⅤⅡ模型表现
Baveno ⅤⅡ标准排除CSPH的灵敏度为98%(95% CI:94%~99%),阴性预测值(NPV)为82%(95% CI:50%~96%)。然而,有80名(47%)患者落入灰色区域,这些患者在3年内的失代偿或死亡风险为9%。使用LSM≥25 kPa作为诊断CSPH的临界值,其特异度为82%(95% CI:69%~92%),阳性预测值(PPV)为89%(95% CI:81%~93%),该组患者在3年内的累积失代偿或死亡率为21%。
AASLD模型表现
根据AASLD标准(LSM≥25 kPa或LSM>20 kPa+血小板减少),灰色区域的患者数量减少至63名(37%),但这些标准的特异度为76%(95% CI:63%~87%),PPV为88%(95% CI:50%~96%),仍有29%的CSPH患者在高风险区域之外。灰色区域患者在3年内的失代偿或死亡风险仍为9%。
新算法(结合Baveno ⅤⅡ/AASLD标准和内镜检查)
对于AASLD标准诊断CSPH的患者(LSM≥25 kPa或LSM>20 kPa+血小板减少),研究者在63名灰色区域的患者中进行内镜检查,识别出26名患者存在静脉曲张并将其重新分类为高风险。新算法的特异度为61%(95% CI:46%~74%),PPV为84%(95% CI:78%~88%),灰色区域显著减少至22%(P=0.002),且86%的CSPH患者被正确分类为高风险。根据新算法,灰色区域和低风险区域的患者在3年内均未出现失代偿事件。
新算法在验证队列中的性能
验证队列共纳入195名患者,其中122名(63%)存在CSPH,89名(51%)存在食管胃底静脉曲张。中位随访时间为42个月,3年内的失代偿或死亡风险为13.3%。在验证队列中,结合AASLD标准与内镜检查的算法特异度为85%,PPV为91%,灰色区域减少至31%(P=0.003),仅有13%的CSPH患者在高风险区域之外。使用完全非侵入性的算法(结合Baveno ⅤⅡ标准和SSM)也得到了相似的结果。
研究者表示,仅基于LSM和PLT的算法在识别NS
参考文献:Dajti E, Villanueva C, Berzigotti A, et al. Exploring algorithms to select candidates for non-selective beta-blockers in cirrhosis: a post-hoc analysis of the PREDESCI trial. J Hepatol. Published online September 18, 2024. doi:10.1016/j.jhep.2024.09.014
(来源:《国际肝病》编辑部)

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
