
编者按
近年来,单细胞转录组测序技术揭示了肝星状细胞(HSC)具有高度的异质性,提示不同的HSC亚群具有独特的基因表达特征和功能。在2024年美国肝病研究学会(AASLD)年会上,首都医科大学附属北京友谊医院尤红教授、杨爱婷副教授团队的一项研究揭示了ECM1高表达HSC亚群在肝纤维化消退中的关键作用,并荣获“大会优秀壁报”殊荣。这一发现不仅深化了我们对肝纤维化发病机制的理解,也为开发新型抗纤维化药物指明了方向。


杨爱婷副教授在AASLD 2024大会现场
研究目的
本研究皆在明确在肝纤维化消退过程中发挥关键作用的HSC亚群。
研究方法
制备四氯化碳(CCl4)和胆碱缺乏、L-氨基酸补充(CDAA)饮食诱导的两种纤维化模型小鼠,通过抑制HSC增殖或清除Lrat+ HSC,观察HSC在上述两种纤维化模型小鼠中的作用。进一步通过RNA-seq测序技术分析在纤维消退中发挥关键作用的新型HSC亚群。
研究结果
1
构建靶向HSC敲除Pdgfra的转基因小鼠(PdgfraΔHSC)以达到抑制HSC增殖的目的。在CCl4诱导的肝纤维化模型中,结果如预期,抑制HSC增殖有效阻断CCl4模型小鼠纤维化进展。令人惊讶的是,在CDAA饮食诱导的NASH纤维化模型,与对照组小鼠相比,PdgfraΔHSC小鼠表现出更多的胶原沉积,加重了NASH纤维化进展。


2
通过注射白喉毒素(DT)清除肝组织中Lrat阳性HSC,明确HSC在纤维形成中的作用。结果发现,在CCl4诱导的肝纤维化模型中,清除Lrat+ HSC阻断了疾病进展。有意思的是,与PdgfraΔHSC小鼠在CDAA模型的表型一致,清除肝组织Lrat+ HSC同样加重了该模型纤维化进展。上述发现提示在CDAA模型中存在一群具有肝纤维化保护作用的HSC亚群。


3
基于RNA-seq测序技术分析,发现细胞外基质蛋白1高表达(ECM1HI)HSC是一群具有抗纤维化作用的新型HSC亚群。
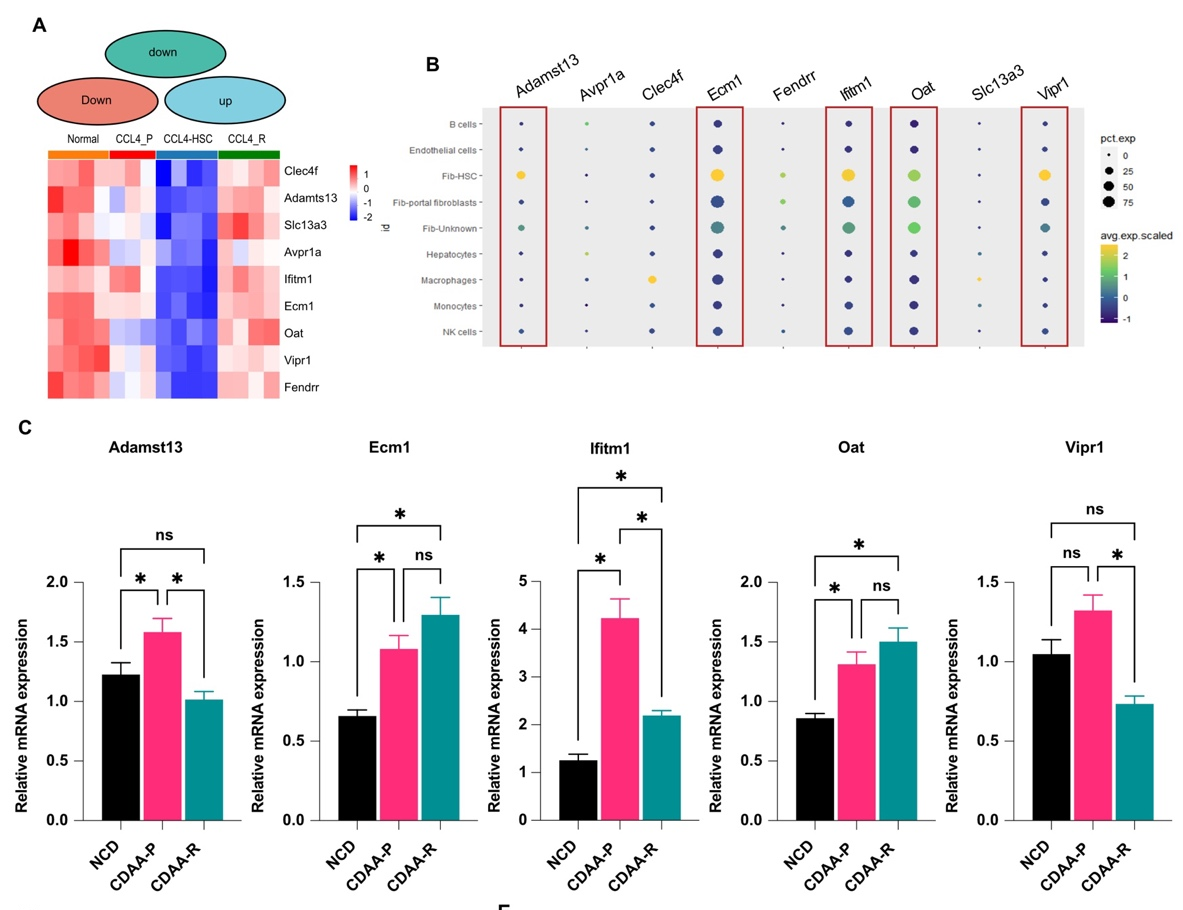
4
构建HSC特异性敲入Ecm1转基因小鼠,明确靶向上调HSC中ECM1的抗纤维化作用。结果表明,HSC特异性上调Ecm1表达,显著抑制CCl4模型肝组织中的纤维沉积,减少肝组织炎症和纤维化相关基因的表达,阻断纤维化进展。
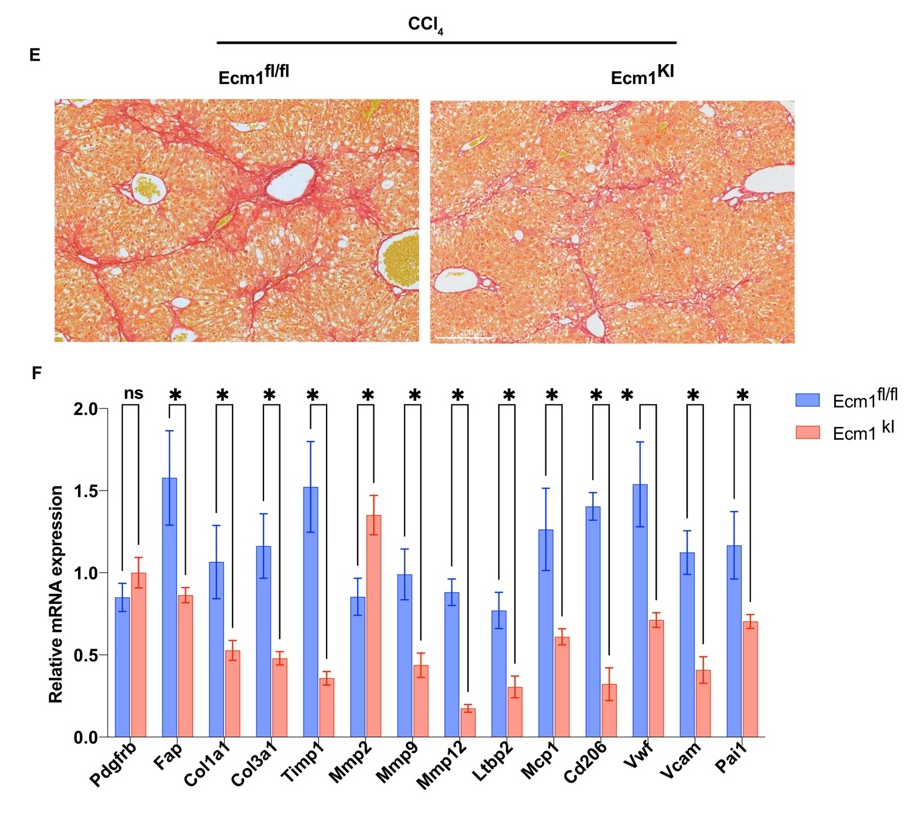
研究结论
ECM1高表达HSC亚群在纤维消退中发挥关键作用,以肝星状细胞ECM1为靶点,为预防和纤维化治疗提供了新的治疗策略。
专家简介

尤红
首都医科大学附属北京友谊医院

杨爱婷
首都医科大学附属北京友谊医院
副研究员,副教授,硕士研究生导师。长期致力于肝纤维化相关的基础研究工作。主持国家自然科学基金项目2项,北京市自然科学基金项目1项。近5年以第一/通讯作者在Cell Mol Gastroenterol Hepatol, Hepatol Int., Hepatol Commun等SCI期刊发表论文6篇。
(来源:《国际肝病》编辑部)

声明:本文仅供医疗卫生专业人士了解最新医药资讯参考使用,不代表本平台观点。该信息不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议,如果该信息被用于资讯以外的目的,本站及作者不承担相关责任。
发表评论
全部评论